
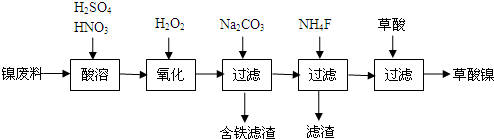
分析 流程分析,镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4•2H2O),再高温煅烧草酸镍制取三氧化二镍.镍废料加入酸溶解后过滤得到滤液中含有亚铁离子、钙离子、镁离子、镍离子,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的PH,使铁离子全部沉淀,过滤后的滤液在加入NH4F沉淀钙离子和镁离子,过滤得到溶液含有镍离子的溶液,在溶液中加入草酸生成草酸镍,蒸发浓缩结晶析出晶体为目标产物NiC2O4•2H2O;
(1)镍废料中主要是镍、铁、钙、镁合金为主,操作Ⅰ是酸溶后过滤,溶解金属,除去不溶物,提高为提高酸溶操作中镍废料的转化率可以延长酸溶时间,提高温度、酸的浓度、充分搅拌,研磨废料增大接触面积等影响反应速率的因素分析;
(2)过氧化氢氧化亚铁离子为铁离子,依据电荷守恒和原子守恒书写离子方程式;
(3)氟化钙、氟化镁难溶于水;
(4)依据电池反应,放电为原电池反应,负极是LaNi5H6在碱溶液中失电子生成LaNi5;
(5)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确;依据化学方程式和元素守恒计算得到,依据原子守恒分析写出化学式;
解答 解:流程分析,镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4•2H2O),再高温煅烧草酸镍制取三氧化二镍.镍废料加入酸溶解后过滤得到滤液中含有亚铁离子、钙离子、镁离子、镍离子,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的PH,使铁离子全部沉淀,过滤后的滤液在加入NH4F沉淀钙离子和镁离子,过滤得到溶液含有镍离子的溶液,在溶液中加入草酸生成草酸镍,蒸发浓缩结晶析出晶体为目标产物NiC2O4•2H2O;
(1)镍废料中主要是镍、铁、钙、镁合金为主,操作Ⅰ是酸溶后过滤,溶解金属,除去不溶物,提高为提高酸溶操作中镍废料的转化率可以延长酸溶时间,提高温度、酸的浓度、充分搅拌,研磨废料增大接触面积等影响反应速率的因素分析;
故答案为:延长酸溶时间,提高酸溶温度、酸的浓度、充分搅拌,研磨废料增大接触面;
(2)加双氧水的目的是氧化生成Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)再加入NH4F的目的是除去钙离子、镁离子;
故答案为:Ca2+、Mg2+;
(4)依据电池反应,3Ni2O3+LaNi5H6+3H2O$?_{充电}^{放电}$LaNi5+6Ni(OH)2.该电池放电时为原电池反应,负极是LaNi5H6在碱溶液中失电子生成LaNi5,电极反应为:LaNi5H6-6e-+6OH-=LaNi5+6H2O;
故答案为:LaNi5H6-6e-+6OH-=LaNi5+6H2O;
(5)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O
1 2
n(ClO-) a mol
则n(ClO-)=0.5 a mol
Cl2+2OH-═ClO-+Cl-+H2O
0.8n(Cl2) 0.5 a mol
则n(Cl2)=0.625 a mol
进行电解时:2Cl--2e-═Cl2↑
2 1
n(e-) 0.625 a mol
则n(e-)=1.25a mol;
0.2 mol水的质量为3.6g,则m(Ni2O3)=20.2 g-3.6g=16.6g,n(Ni2O3)=0.1mol,即:n(Ni2O3):n(H2O)=0.1mol:0.2 mol=1:2,再利用原子守恒写成结晶水合物的形式,“1mol该物质中含有0.5 mol结晶水”,即NiOOH•$\frac{1}{2}$H2O或整合成:2NiOOH•H2O;
故答案为:1.25a mol;NiOOH•$\frac{1}{2}$H2O 或2NiOOH•H2O.
点评 本题考查了流程分析推断,实验操作步骤的分析判断,化学方程式计算和电解原理分析应用,题目综合性较大,难度较大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水结成冰体积膨胀 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com