
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 |
① | 制氧气 | H2O2→O2 |
② | 制氨气 | NH4Cl→NH3 |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是_________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是______,写出实验室制取该气体的化学方程式_______________________________
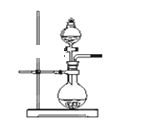
(2)若用上述装置制备NH3,则选择的试剂为____________________。
(3)制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为__________mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是_______________(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
【答案】Cl2 NH3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 浓氨水和生石灰(或氢氧化钠或碱石灰) 66.7mL BC
CaCl2+2NH3↑+2H2O 浓氨水和生石灰(或氢氧化钠或碱石灰) 66.7mL BC
【解析】
(1)反应①为分解反应,不需另加氧化剂;反应②为非氧化还原反应;反应③制备氯气的反应,HCl中的Cl化合价升高,HCl作还原剂,反应需要额外加入氧化剂,。答案为Cl2。
反应①、③为氧化还原反应,有电子转移;反应②为非氧化还原反应,无电子转移。明显不同于其他气体的是NH3。答案为NH3;
实验室用氯化铵和熟石灰反应制取氨气,反应的化学方程式为
Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 答案为Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O 答案为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)若用图中不需加热的装置制备NH3,可选择浓氨水和生石灰(或氢氧化钠或碱石灰),利用生石灰(或氢氧化钠或碱石灰)吸水放热的特点制备氨气。答案为:浓氨水和生石灰(或氢氧化钠或碱石灰);
(3) ①利用稀释前后溶液的物质的量相等建立等量关系式
需要12 mol/L的盐酸的体积为![]() 答案为66.7mL
答案为66.7mL
②A.使用容量瓶前检查它是否漏水,正确;
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗,必然产生误差,错误;
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,此操作错误,因为溶质必须放入烧杯内加水溶解,不能直接放入容量瓶内;
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次,正确;
故答案为BC。


科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是
A. 分子中有N、O、F原子,分子间就存在氢键
B. 因为氢键的缘故,![]() 比
比![]() 熔沸点高
熔沸点高
C. 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D. “可燃冰”——甲烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布图为_____。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是____________。
(3)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,同时得到一种最简单的有机物,写出该反应的方程式为_____;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm(1pm=10-12m),则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式正确的是
A.用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓
B.SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32-
C.用石墨电极电解AlCl3溶液,阴极附近生成沉淀:2Al3++6H2O+6e- =2Al(OH)3↓+3H2↑
D.工业上制取硅:SiO2+C![]() Si+CO2
Si+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() 。下列相关说法不正确的是 ( )。
。下列相关说法不正确的是 ( )。
A.苹果酸能发生酯化反应的官能团有3个
B.苹果酸在一定条件下能发生催化氧化反应
C.1 mol苹果酸与足量Na反应生成33.6 L H2
D.1 mol苹果酸与NaHCO3溶液反应,最多消耗2 mol NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
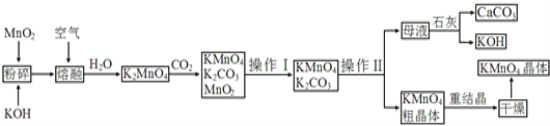
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________ (填性质)上差异,采用 __________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、____和____ (写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:________________。
(7)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 甲酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B. 醋酸溶液与Cu(OH)2:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
C. 苯酚钠溶液通少量CO2 :2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 甲醛溶液与足量的银氨溶液共热:HCHO +4Ag(NH3)2++4OH-![]() CO32-+2NH4++4Ag↓ +6NH3+2H2O
CO32-+2NH4++4Ag↓ +6NH3+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com