
| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
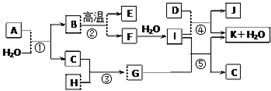 如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法.
如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法. ;I中所含化学键类型离子键、共价键.
;I中所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2是氧元素的两种核素 | |
| B. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2均含有0.1NA个氧原子 | |
| C. | 通过化学变化可以实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间的相互转化 | |
| D. | ${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O核外电子排布方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)(需要写出简单的求解步骤)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)(需要写出简单的求解步骤)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com