
分析 I.向铝土矿中加入过量H2SO4,可溶解氧化铝和Fe3O4;
Ⅱ.滤液中含有硫酸铝、硫酸铁和硫酸亚铁,向滤液中加入一定量的双氧水,可氧化硫酸亚铁生成铁离子;
Ⅲ.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤;
IV.加入稳定剂,加热,得到聚合硫酸铝铁.
(1)Fe3O4与H2SO4反应生成Fe3+、Fe2+;
(2)过滤时用到烧杯、漏斗、玻璃棒等仪器;
(3)酸性条件下,过氧化氢和氧化Fe2+生成Fe3+;
(4)电解时,铝被氧化生成氧化铝,阳极水参加反应.
解答 解:I.向铝土矿中加入过量H2SO4,可溶解氧化铝和Fe3O4;
Ⅱ.滤液中含有硫酸铝、硫酸铁和硫酸亚铁,向滤液中加入一定量的双氧水,可氧化硫酸亚铁生成铁离子;
Ⅲ.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤;
IV.加入稳定剂,加热,得到聚合硫酸铝铁.
(1)Fe3O4与H2SO4反应生成Fe3+、Fe2+,反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(2)过滤时用到烧杯、漏斗、玻璃棒等仪器,因二氧化硅与硫酸不反应,则滤渣中含有SiO2,故答案为:普通漏斗、玻璃棒、烧杯; SiO2;
(3)酸性条件下,过氧化氢和氧化Fe2+生成Fe3+,反应的离子方程式为H2O2+2Fe2++2H+=2H2O+2Fe3+,故答案为:H2O2+2Fe2++2H+=2H2O+2Fe3+;
(4)电解时,铝被氧化生成氧化铝,阳极水参加反应,电极方程式为2Al-6e-+3H2O=Al2O3+6H+,故答案为:2Al-6e-+3H2O=Al2O3+6H+.
点评 本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫遇水生成亚硫酸,容易引起胃肠道反应 | |
| B. | 人体直接吸入二氧化硫易引起呼吸道疾病 | |
| C. | 二氧化硫引起的环境问题主要是酸雨 | |
| D. | 可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
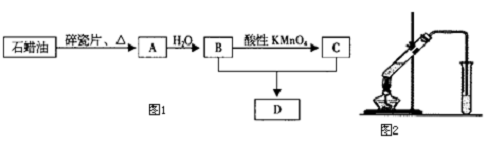
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症 | |
| B. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键 | |
| C. | 分子式为C5H12的有机物只有三种,它们互为同系物 | |
| D. | 乙酸乙酯的水解反应;苯和硝酸反应生成硝基苯,两者的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
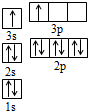 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过二硫酸钾的化学式为K2S2O8,其中硫元素为+6价 | |
| B. | KMnO4和K2MnO4中原子团组成相同,其化学性质相同 | |
| C. | 有机物的分子式、结构简式、实验式都不相同 | |
| D. | 摩尔质量相同的物质,其化学式一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O═C6H5OH+HCO3- | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+2H2O | |
| D. | 醋酸溶液中加入少量CaCO3固体:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com