
 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;
(2)①利用盖斯定律计算反应热;
②二氧化硫使酸性氧化物和碱或碱性盐溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算;
②依据化学反应速率和平衡移动原理分析判断;
③根据G=△H-T•△S判断反应能否自发进行;
(4)①NO被CO还原,则CO被NO氧化生成二氧化碳,据此写出反应方程式;
②原子半径越大,其吸收范围越大,则吸收能力越强;
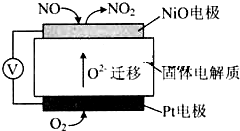
(5)①原电池中正极得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性,试样的pH值根据溶液中电荷守恒计算,c(K+)+c(Na+)+c(H+)+c(NH4+)=c(Cl-)+2c(SO42-)+c(NO3-),c(H+)=2×10-5 +2×4×10-5 +3×10-5-2×10-5-6×10-6-4×10-6 =10-4,得到H+离子浓度为10-4,pH值=-lgc(H+)=4,
故答案为:酸性;4;
(2)①已知:①H2 (g)+$\frac{1}{2}$O2 (g)=H2O(g);△H=-241.81kJ•mol-1,
②C (s)+$\frac{1}{2}$O2 (g)=CO (g);△H=-110.51kJ•mol-1,
利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g);△H=(-110.51kJ•mol-1)-(-241.81kJ•mol-1)=+13l.3 kJ•mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g);△H=+13l.3 kJ•mol-1;
②洗涤含SO2的烟气,根据酸性氧化物的性质选a.Ca(OH)2 b.Na2CO3,
故答案为:a、b;
(3)①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$=$\frac{(8×1{0}^{-4}mol)^{2}}{(0.8-4×1{0}^{-4})mol×(0.2-4×1{0}^{-4})mol}$=4×10-6,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:4×10-6,温度升高,反应速率加快,平衡右移;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现;
故答案为:该反应是焓增、熵减的反应.根据△G=△H-T△S,△G>0,不能实现;
(4)①在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
②根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素.同一主族的元素,从上到下,原子半径逐渐增大,原子半径越大,反应接触面积越大,则吸收能力越大,
故答案为:由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大;
(5)①装置无外接电源,故为原电池,铂电极上氧气得电子生成氧离子而被还原,所以为正极,故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,故答案为:NO+O2--2e-=NO2.
点评 本题综合考查化学反应原理的基础知识,涉及离子的水解、PH值的计算、盖斯定律的应用、化学平衡常数的计算、自由能的应用等,题目难度中等,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | v(A)=1mol/(L•s) | B. | v(B)=1.5mol/(L•s) | C. | v(C)=2mol/(L•s) | D. | v(D)=3mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种元素的相对原子质量为m+n | |
| B. | 若碳原子质量为wg,则此原子的质量为(m+n)wg | |
| C. | 不能由此确定该元素的相对原子质量 | |
| D. | 核内中子的总质量小于质子的总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
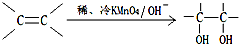 ).在下列转化关系中,P为高分子化合物.
).在下列转化关系中,P为高分子化合物.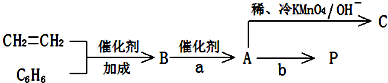
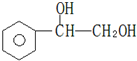 ,C与足量醋酸反应的化学方程式为
,C与足量醋酸反应的化学方程式为 ;
;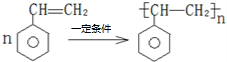 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21.6g | B. | 26.8g | C. | 23.4g | D. | 31.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com