
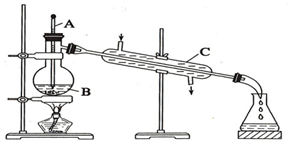
 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题分析 (1)由图可知仪器的名称;
(2)蒸馏烧瓶需要加石棉网加热、温度计测定馏分的温度、冷却水下进上出冷凝效果好;
(3)仪器B中加入碎瓷片,可防止液体剧烈沸腾;
(4)酒精与水互溶,易形成共沸混合物,应加CaO后蒸馏.
解答 解:(1)由图可知仪器A、B、C的名称分别为温度计、蒸馏烧瓶、冷凝管,故答案为:温度计;蒸馏烧瓶;冷凝管;
(2)由图可知,图中错误为蒸馏烧瓶未垫石棉网加热、温度计的水银球未在烧瓶支管口处、冷却水未下进上出,
故答案为:蒸馏烧瓶未垫石棉网加热;温度计的水银球未在烧瓶支管口处;冷却水未下进上出;
(3)仪器B中加入碎瓷片的作用为防止暴沸,故答案为:防止暴沸;
(4)酒精与水互溶,易形成共沸混合物,应加CaO后蒸馏,不能分液或过滤分离,故答案为:B.
点评 本题考查混合物分离提纯,为高频考点,把握图中装置的作用、仪器的使用、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意实验基本操作和与实验技能,题目难度不大.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3△H1+2△H2-△H3 | B. | △H1+△H2-△H3 | C. | 3△H1+△H2+△H3 | D. | 3△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
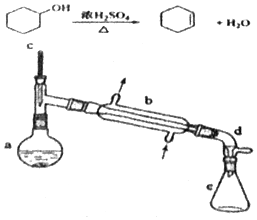 分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:
分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4 L | B. | 11.2 L | C. | 14.0 L | D. | 16.8 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com