
在25℃,101kPa条件下,将15
L![]() 通入10 LCO和
通入10 LCO和![]() 的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
(1)若剩余气体的体积是15 L,则原CO和![]() 的混合气中,V(CO)=________L,V(
的混合气中,V(CO)=________L,V(![]() )=________L.
)=________L.
(2)若剩余气体的体积为a L,则原CO和![]() 的混合气中,V(CO)∶V(
的混合气中,V(CO)∶V(![]() )=________.
)=________.
(3)若剩余气体的体积为a L,则a的取值范围是________.
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:阅读理解
 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.| 充电 | 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:
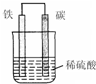
查看答案和解析>>
科目:高中化学 来源:2014届山西省晋中市高二下学期期末考试化学试卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
|
Y |
Y是地壳中含量最高的元素 |
|
Z |
Z的基态原子最外层电子排布式为3s23p1 |
|
W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com