
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
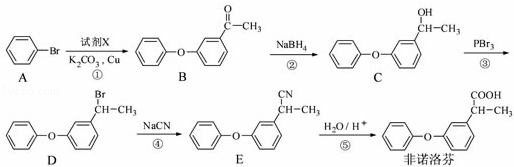
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称).
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 .
(3)在上述五步反应中,属于取代反应的是 (填序号).
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式: .
(5)根据已有知识并结合相关信息,写出以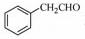 为原料制备
为原料制备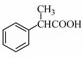 的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
CH3CH2Br CH3CH2OH
CH3CH2OH CH3COOCH2CH3.
CH3COOCH2CH3.
| 真题集萃;有机物的合成. | |
| 专题: | 有机物的化学性质及推断. |
| 分析: | 根据流程图中,A发生取代反应生成B,B发生还原反应生成C,C发生取代反应生成D,D发生取代反应生成E,E发生水解反应生成F, (1)该物质中的官能团是醚键和羧基; (2)A发生取代反应生成B,根据A、B分子式的差异并结合X的分子式确定其结构简式; (3)根据反应物和生成物变化确定反应类型; (4)Ⅰ、能发生银镜反应,说明含有醛基,其水解产物之一能与FeCl3溶液发生显色反应,说明含有酚羟基; Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环,说明该分子中含有两个苯环且H原子种类是6; (5)苯乙醛和NaBH4发生还原反应生成苯乙醇,苯乙醇发生消去反应生成苯乙烯,苯乙烯发生加成反应生成 |
| 解答: | 解:根据流程图中,A发生取代反应生成B,B发生还原反应生成C,C发生取代反应生成D,D发生取代反应生成E,E发生水解反应生成F, (1)该物质中的官能团是醚键和羧基,故答案为:醚键和羧基; (2)A发生取代反应生成B,根据A、B分子式的差异并结合X的分子式知,在B的醚键处断键,使醚基转化为酚羟基连接在X上,所以X的结构简式为,故答案为:; (3)通过以上分析知,属于取代反应的有①③④,故答案为:①③④; (4)Ⅰ、能发生银镜反应,说明含有醛基,其水解产物之一能与FeCl3溶液发生显色反应,说明含有酚羟基; Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环,说明该分子中含有两个苯环且H原子种类是6,则符合条件的结构简式为,故答案为:; (5)苯乙醛和NaBH4发生还原反应生成苯乙醇,苯乙醇发生消去反应生成苯乙烯,苯乙烯发生加成反应生成,和NaCN发生水解反应生成, 其合成路线图为 , 故答案为:. |
| 点评: | 本题考查了有机物的合成,明确有机物中含有的官能团及其性质是解本题关键,利用题给信息解答(5)题,注意反应条件和有机物断键和成键位置,题目难度中等. |


科目:高中化学 来源: 题型:
某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
(1)该同学应选择________ mL的容量瓶。
(2)其操作步骤如右图 所示,则如图操作应在下图中的__________(填选项字母)之间。
所示,则如图操作应在下图中的__________(填选项字母)之间。
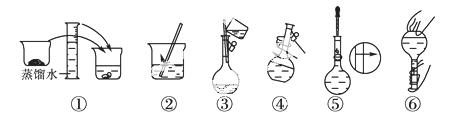
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) △H=a kJ·mol-1
2SOCl2 (g) △H=a kJ·mol-1
SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2 (g) SO2Cl2(g) △H = ▲ kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = ▲ 。
SO2Cl2(g) △H = ▲ kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = ▲ 。
(2)磺酰氯可与白磷发生反应为:P4 + 10 SO2Cl2 = 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 ▲ mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如题20图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如题20图-1。

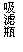

①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为 ▲ 。
②有关题20图-1所示的装置说法正确的是 ▲ (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为 ▲ 。
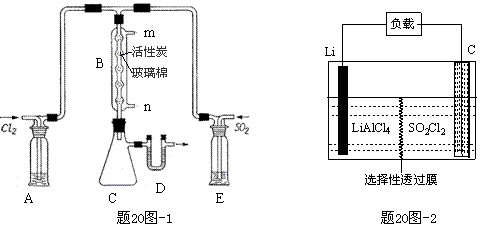
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如题20图-2所示,已知电池反应为:
2Li + SO2Cl2 = 2LiCl + SO2↑;则电池工作时,正极的电极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
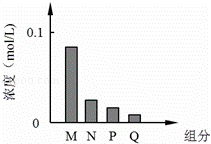
|
| A. | 图中N表示HA,P表示OH﹣,Q表示H+ | B. | 若V=10 mL,则pH=7 |
|
| C. | 若V<10 mL,则溶液显酸性 | D. | 若V=10 mL,则:c(M)+c(P)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液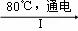 NaClO3溶液
NaClO3溶液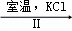 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+ H2O═ NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 .
(4)一定条件下,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.
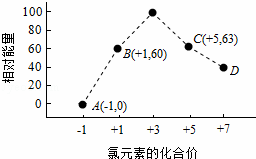
①D是 ﹣ (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表的一部分,下列关系正确的是( )
| S | Cl |
| Se | Br |
A.还原性:Se2->S2->Cl-
B.热稳定性:HCl>H2Se>HBr
C.原子半径:Se>Cl>S
D.酸性:HBrO4>HClO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验活动小组通过实验来探究一包黑色粉末是氧化铜、氧化亚铁或二者的混合物,探究过程如下:
(1)提出假设。
假设1:黑色粉末是FeO。
假设2:黑色粉末是________(写化学式)。
假设3:黑色粉末是FeO和CuO的混合物。
(2)设计探究实验。
实验小组选用稀硫酸、氯水、硫氰化钾溶液做试剂进行实验,请将实验操作步骤及现象填入下表。
| 实验方法步骤 | 现象 | 结论 |
| 取少量粉末加入足量稀硫酸 | 假设1成立 | |
| 假设2成立 | ||
| 假设3成立 |
(3)查阅资料得知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下表:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
若经过实验 分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如下实验方案:
分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如下实验方案:
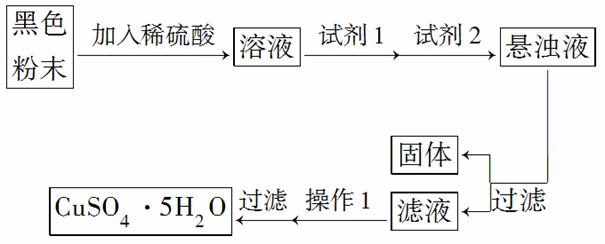
请回答:试剂1是________(填化学式)溶液;加入试剂2的目的是调节溶液的pH,该物质是________(填名称),将溶液pH调节到________(填范围);操作1的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中曲线变化不正确的是
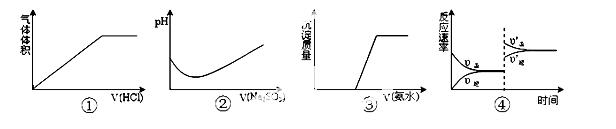
A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示HCl和MgCl2溶液中滴入氨水
D.④表示一定条件下反应:2SO2+O2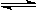 2SO3 ΔH< 0 ,达平衡后,增大压强
2SO3 ΔH< 0 ,达平衡后,增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com