
【10分】某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用。实验步骤如下:
①称量a g胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如下图所示。
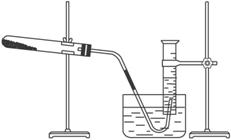
请回答下列问题。
(1)上述各步操作中,需要用到玻璃棒的是_________ (填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为_________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述用pH试纸测定溶液pH的操作:____________________________________________________________________。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①—④后还应该进行的实验操作是(按实验先后顺序填写字母序号) _________。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是_________________________________。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
①称量a g胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如下图所示。
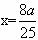
请回答下列问题。
(1)上述各步操作中,需要用到玻璃棒的是_________ (填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为_________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述用pH试纸测定溶液pH的操作:____________________________________________________________________。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①—④后还应该进行的实验操作是(按实验先后顺序填写字母序号) _________。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【10分】(NH4)2SO4是农业生产中常见化肥之一,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉制成CaSO4悬浊液,然后按如下工艺流程进行生产:

(1)操作1与操作2的顺序能否调换?___________(填“能”或“否”),理由是___________
___________________________________。
(2)常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3 g和2.1×10-1 g,请解析CaSO4向CaCO3转化的原因____________________________________________________________________。
(3)判断操作2通入的是“适量CO2”的简单实验方法是_____________________________。
(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是_________________。
(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【3分】某学生做完实验以后,采用以下方法分别清洗所用仪器:①用稀HNO3清洗做过银镜反应的试管。②用酒精清洗做过碘升华的烧杯。③用浓盐酸清洗做过KMnO4分解实验的试管。④用盐酸清洗长期存放过FeCl3溶液的试剂瓶。⑤用NaOH溶液清洗盛放过苯酚的试管。你认为他的操作( )
A.只有①②正确 B.只有③④正确
C.①②③④正确 D.①②③④⑤全正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【10分】某些同学在学习了氨的性质时探究讨论:既然氨气具有还原性,能否像H2那样还原CuO呢?
(一)制取氨气
(1)写出实验室制取氨气的化学方程式:________________。
(2)有一同学模仿排饱和食盐水收集氯气的方法用排饱和氯化铵溶液的方法收集氨气。但另一同学认为他不能达到目的,理由是_____________________________________________。
(二)该小组某同学设计如下图装置(夹持及尾气处理装置未画出),探究氨气的还原性:
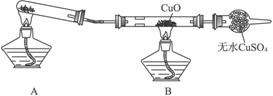
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是__________________。
(2)利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为_________________。
(三)问题讨论
有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O,已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+![]() Cu+Cu2+)。请设计简单实验检验该红色物质中是否含有Cu2O:____________。
Cu+Cu2+)。请设计简单实验检验该红色物质中是否含有Cu2O:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com