
【题目】Ⅰ.已知亚硝酸钠能发生如下反应:2NaNO2+ 4HI= 2NO + I2 + 2NaI + 2H2O
(1)用双线桥表示电子转移的方向与数目__________。
(2)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为_________。
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
(1)该反应中还原产物为__________。
(2)每生成2molCuI,有__________mol KI被IO3-氧化。
【答案】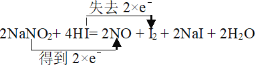 NA I2、CuI 20
NA I2、CuI 20
【解析】
亚硝酸钠中氮的化合价降低,碘化氢中碘的化合价升高,有4 mol HI参与反应,但只有2 molHI被氧化;2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O中,KI中I的化合价升高,Cu(IO3)2中铜、碘化合价降低。
Ⅰ⑴氮元素的化合价由+3价降至+2价,I元素的化合价由-1价升至0价,用双线桥表示电子转移的方向与数目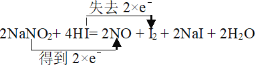 ,故答案为:
,故答案为: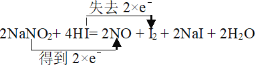 ;
;
⑵根据反应方程式有4 molHI作为反应物,但只有2 molHI作还原剂,转移2 mol电子,因此有1mol还原剂被氧化,则在此反应中发生转移的电子数目为NA,故答案为:NA;
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
⑴Cu(IO3)2中的碘的化合价由+5价降低变为单质碘中的0价,铜的化合价由+2价降至碘化亚铜中的+1价,I2、CuI都是还原产物,因此还原产物为I2、CuI,故答案为:I2、CuI;
⑵根据反应方程式得出,每生成2molCuI,有2 mol+2价的铜氧化2 mol I-生成1 mol单质碘,而+2价铜变为+1价铜,有4 molIO3-氧化20 mol I-生成10 mol单质碘,因此每生成2molCuI,有20 mol KI被IO3-氧化,故答案为20。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在恒温、体积为2.0L的密闭容器中通入1.0mol N2和1.0mol H2发生合成氨反应,20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的总物质的量为1.6mol,请回答下列问题:
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率ν(NH3)=____。
(2)平衡时,N2的转化率为____,NH3的体积分数为____,平衡时体系的压强为起始时压强的____倍。
(3)该反应的热化学方程式为____。
(4)若拆开1mol H-H键和1mol N![]() N键需要的能量分别是436kJ和946kJ,则拆开1mol N-H键需要的能量是____kJ。
N键需要的能量分别是436kJ和946kJ,则拆开1mol N-H键需要的能量是____kJ。
(5)判断该反应达到平衡状态的依据是____(填序号)。
①单位时间内消耗1mol N2的同时消耗了3mol H2;
②单位时间内断裂1mol N≡N的同时断裂了6mol N–H;
③ν正(N2)= ν逆(NH3);
④NH3的物质的量分数不再随时间而变化;
⑤容器内气体的压强不再随时间而变化的状态;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒和硫是同一主族元素,二氧化硒(SeO2))是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1 :1,写出Se和浓HNO3的反应方程式_______________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO42-+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①__SeO2+__KI+__HNO3―→__Se+__I2+__KNO3+__H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平方程式①,用单线桥标出电子转移的方向和数目。__________________
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y原子核外电子有6种不同的运动状态;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K的+1价阳离子的核外有3层电子且各层均处于全满状态;L位于ds区,它的基态原子的N层上只有2个电子。
请回答下列问题:(答题时,X、Y、Z、W、K、L用所对应的元素符号表示)
(1)ZX5为离子化合物,写出它的电子式_________________。
(2) K的基态原子的电子排布式是______________________。
(3) Y、Z、W元素的第一电离能由大到小的顺序是__________________。
(4)第一电离能I1(L)__I1(K)(填“大于”或“小于”),原因是________________
(5)Y2X4是石油炼制的重要产物之一, 1mol Y2X4分子中含σ键为______mol;
(6)肼(Z2H4)可用作火箭燃料,其原理是:Z2O4(l)+2Z2H4(l)=3Z2(g)+4H2O(g),若反应中有4mol Z-H键断裂,则形成的π键有_________mol.
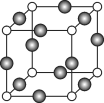
(7)Z、K两元素形成的某化合物的晶胞结构如图所示,则Z原子的配位数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示:
(1)根据下列几种粒子的结构示意图,回答问题:

①写出B微粒的符号_________;
②若A微粒的中子数为10,写出表示A微粒的组成符号________;
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:_________;
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热____________;
②工业上制备氯气____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列说法正确的是____________。
A 漂白粉在空气中容易失效的原因是次氯酸钙易分解为氯化钙和氧气
B 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,证明该溶液一定是钠盐溶液
C 用托盘天平可以准确称量氢氧化钠固体8.80g
D 烧杯中红褐色的透明液体是氢氧化铁胶体还是溴水用可见光束可以鉴别
E 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
F 分液操作时,待下层液体流出后,及时关闭活塞并从上口倒出上层液体
(2)现有四瓶溶液分别是NH4NO3溶液、NaCl溶液、(NH4)2 SO4溶液、MgSO4溶液,可用于鉴别它们一种试剂(可适当加热)是_______。(填试剂名称)
(3)如果采用如图装置完成收集氯气,气体的进入口是__________(填写字母)。
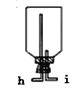
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含Cr2072-的废水,探究不同因素对含Cr2072-废水处理的影响,结果如表所示(Cr2072-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(S04)3 | 否 | 否 | 否 | ||
是否加入H2S04 | 否 | 加入lmL | 加入lmL | 加入lmL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2072-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2072-的机理 |
A. 实验ii与实验i对比,其他条件不变,增加c(H+)有利于Cr2072-的去除
B. 实验iii与实验ii对比,其他条件不变,增加c(Fe3+)有利于Cr2072-的去除
C. 实验iv中循环利用提高了Cr2072-的去除率
D. 若实验iv中去除O.OlmolCr2072-电路中共转移0.06mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4gCu参加反应时,计算:
(1)用双线桥法标出电子转移的方向和数目;
(2)能生成多少升NO(标准状况下);
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,则至少需要质量分数为40%密度为1.42g/ml的NaOH溶液体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
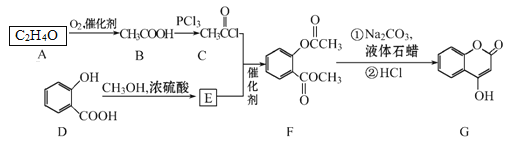
请回答:
(1)C+E→F的反应类型是____。
(2)F中含有的官能团名称为____。
(3)在A→B的反应中,检验A是否反应完全的试剂为_____。
(4)写出G和过量NaOH溶液共热时反应的化学方程式_____。
(5)化合物E的同分异构体很多,符合下列条件的结构共____种。
①能与氯化铁溶液发生显色;②能发生银镜反应;③能发生水解反应
其中,核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的结构简式为___。
(6)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com