
下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是___▲____。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是___▲____(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是___▲____。证明FeCl2与Cl2发生了氧化还原反应的实验方法是___▲____。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是___▲____。
④该实验存在明显的缺陷,改进的方法是___▲____。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 === Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为___▲____。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列8种物质:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)_________________________________________________________。
(3)④与足量的NaOH浓溶液在加热条件下反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家把药物连接在高分子载体上制成缓释长效药剂。阿司匹林的结构简式为: ,它可以连接在一个高聚物载体上,形成缓释长效药剂,其中一种药剂的结构简式为:
,它可以连接在一个高聚物载体上,形成缓释长效药剂,其中一种药剂的结构简式为:

请回答:
(1)缓释长效阿司匹林的载体的结构简式为________。
(2)服药后在人体内通过水解作用,可以缓慢地释放出阿司匹林,写出这个水解反应的化学方程式:________。
(3)这种高分子载体是由单体发生聚合反应得到的,写出单体的结构简式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= 。有关该平衡体系的说法正确的是( )
。有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A.K2和K1的单位均为mol/L
B.K2<K1
C.c2(CO)=c2(H2O)
D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
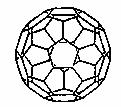
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。
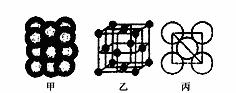
(3)Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5)下列说法正确的是________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是 ,所发生反应的化学方程式是 。
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:
① ,② 。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是 (填编号)。
A.有气体生成 B.钠融化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成 D.溶液变浑浊
(3)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com