
| 实 验 操 作 | 答案 | 实验现象 |
| (1)向鸡蛋清中滴加少许浓硝酸,微热 | B | A.紫色褪去 B.变黄色 C.出现蓝色 D.溶液分层,下层呈紫红色 |
| (2)将乙烯通入少量酸性KMnO4溶液中 | A | |
| (3)将CCl4滴入盛有碘水的试管中,充分振荡,静止 | D | |
| (4)向土豆片上滴加碘水 | C |
分析 (1)蛋白质与硝酸发生显色反应;
(2)乙烯和酸性高锰酸钾发生氧化还原反应;
(3)四氯化碳可萃取碘水中碘;
(4)土豆中富含淀粉,碘单质遇到淀粉会变蓝色.
解答 解:(1)蛋白质与硝酸发生显色反应,变成黄色,故答案为:B;
(2)乙烯和酸性高锰酸钾发生氧化还原反应,溶液褪色,故答案为:A;
(3)碘易溶于CCl4,溶液呈紫红色,由于CCl4密度比水大,则上层为无色下层为紫红色,故答案为:D;
(4)土豆中富含淀粉,向土豆片上滴加碘水,碘单质遇到淀粉会变蓝色,所以会看到变蓝,故答案为:C.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握相关物质的性质,把握颜色的变化,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由该氯原子构成氯分子(Cl2)的相对分子质量为$\frac{24a}{b}$ | |
| B. | mg该氯原子的物质的量为$\frac{m}{aNA}$ mol | |
| C. | ng该氯原子所含的电子数为$\frac{17n}{aNA}$ | |
| D. | 1mol该氯原子的质量为aNA g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,原物质一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:
某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
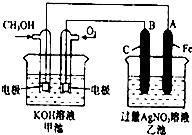 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液中 | B. | 将Cl2通入KI溶液中 | ||
| C. | 将SO2通入溴水中 | D. | 将H2S通入硝酸溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com