
| A. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| B. | 配制标准溶液的固体NaOH中混有杂质KOH | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 | |
| D. | 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
分析 标准的NaOH溶液滴定未知浓度的盐酸,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,V(NaOH)偏小或V(盐酸)偏大,导致测定结果偏低,以此来解答.
解答 解:A.终点读数时,俯视滴定管的刻度,V(NaOH)偏小,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏低,故A选;
B.配制标准溶液的固体NaOH中混有杂质KOH,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏高,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏高,故C不选;
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,测定结果偏高,故D不选;
故选A.
点评 本题考查酸碱中和滴定,为高频考点,把握中和滴定原理、实验操作为解答的关键,侧重分析与实验能力的考查,注意锥形瓶不能润洗,结合计算式分析误差,题目难度不大.


科目:高中化学 来源: 题型:解答题
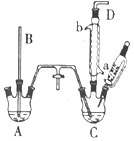 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$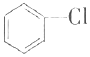 +HCl
+HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{V}$mol•L-1 | B. | $\frac{2m}{27V}$mol•L-1 | C. | $\frac{m}{18V}$mol•L-1 | D. | $\frac{m}{34V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氯化铁溶液的颜色变深 | |
| B. | NaHCO3做发酵粉时加入柠檬酸后效果更好 | |
| C. | 0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L | |
| D. | 常温下,CaCO3的饱和溶液pH约为9.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
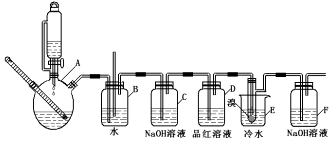
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com