
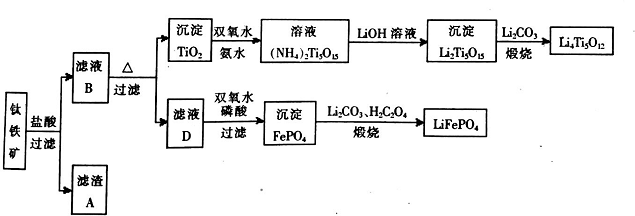
分析 铁矿石加入盐酸溶解过滤得到滤渣A为二氧化硅,滤液B中含有MgCl2、CaCl2、FeCl2、TiCl2等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4.
(1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
(2)MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;根据干冰、二氧化硅的晶体归属解释熔沸点差异很大的原因,SiO2属于原子晶体,干冰属于分子晶体,原子晶体的熔沸点高于分子晶体;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
(4)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
(5)充电时按照电解槽进行分析,阳极氧化阴极还原,写出阳极放电的电解方程式即可.
解答 解:(1)非氧化还原反应没有化合价的变化,反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,由Fe2+可以判断化合物FeTiO3中铁元素的化合价为+2价,
故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,干冰属于分子晶体,二氧化硅属于原子晶体,原子晶体中原子以共价键结合,分子晶体中分子以分子间作用力相结合,干冰气化需克服分子间作用力,而化学键没有变化,二氧化硅熔化时需破坏碳碳共价键,所以原子晶体的熔沸点高于分子晶体;
故答案为:SiO2;SiO2属于原子晶体,干冰属于分子晶体,原子晶体的熔沸点高于分子晶体;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H++4Cl-;
(4)根据电子守恒,过氧化氢氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,因此可得关系式:H2O2~H2C2O4,
设双氧水质量为x,草酸质量为y,则:
H2O2~H2C2O4
34 90
x×17% y
所以34y=90×x×17%,整理可得x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:20:9;
(5)充电时,阳极发生氧化反应,LiFePO4失去电子生成FePO4,电极反应为:LiFePO4-e-=FePO4+Li+,
故答案为:LiFePO4-e-=FePO4+Li+.
点评 本题以钛铁矿制备锂离子电池电极材料工艺流程为载体,考查陌生方程式书写、元素化合物性质、对条件控制的分析评价、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2投入水中 | B. | 铜片投入到FeCl3溶液中 | ||
| C. | NaHCO3溶液和NaOH溶液混合 | D. | 过量氨水加入到AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
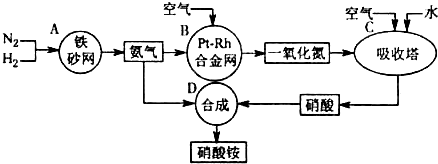
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
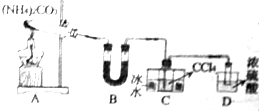 尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.
尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
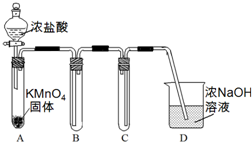 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (5)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, 生成黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
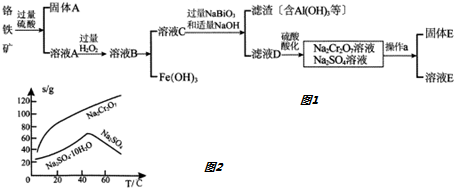

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 放热反应的发生无需任何条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
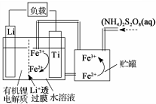
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O32-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的正极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe2+=Li+Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com