
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、氯化钡和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
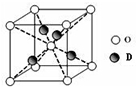 现有部分前36号元素的性质或原子结构如下表:
现有部分前36号元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | 其一种原子的原子核内无中子 |
| B | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| C | C原子的M层电子数是K层的3倍 |
| D | D2+的水溶液呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
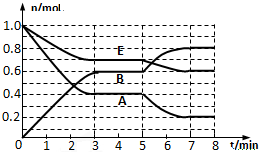 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.查看答案和解析>>
科目:高中化学 来源: 题型:
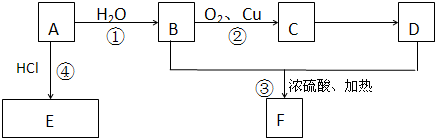
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com