
(16分)氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2  过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3  过滤
过滤 过量HCl
过量HCl
B.过量的NaOH  过量Na2CO3
过量Na2CO3  过量BaCl2
过量BaCl2  过滤
过滤  过量HCl
过量HCl
C.过量的BaCl2  过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH  过滤
过滤  过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式 。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。

阴极反应式为 ;反应类型 (填氧化或还原反应),
总电极反应式为 。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
① 下列收集Cl2的装置正确的是 ;
②检验是否有氯气生成可采用的方法是 ;
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式 。
④ 如下图所示,往漂粉精溶液中持续通入SO2 的过程中,可观察到的现象有(至少写出两点) 。

(1)A、C , H++OH―= H2O; 2H+ + CO32― = H2O +CO2↑;
(2)

阴极:2H++ 2e―=H2↑; 还原反应; 2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3) ①C ; ②C、D;③2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
④溶液中先出现浑浊最后产生大量白色沉淀;溶液颜色由无色变为黄绿色最后黄绿色褪去;液面上方出现白雾。
【解析】
试题分析:(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是A、C;即保证在Ca2+之前除去SO42-,否则会使操作繁琐;加入盐酸后可能发生的化学反应的离子方程式是H++OH―= H2O;2H+ + CO32― = H2O +CO2↑;(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。电解饱和食盐水装置及标出阴阳极和通电时溶液中离子移动的方向为 ;由于阳离子的沸点能力H+>Na+,所以在阴极溶液中的阳离子H+得到电子,发生还原反应,阴极反应式为2H++ 2e―=H2↑;在阳极Cl-失去电子发生氧化反应,电极反应式是:2Cl—-2e-=Cl2↑;总反应方程式是:2NaCl+2H2O
;由于阳离子的沸点能力H+>Na+,所以在阴极溶液中的阳离子H+得到电子,发生还原反应,阴极反应式为2H++ 2e―=H2↑;在阳极Cl-失去电子发生氧化反应,电极反应式是:2Cl—-2e-=Cl2↑;总反应方程式是:2NaCl+2H2O  2NaOH+H2↑+Cl2↑;(3)①由于氯气的密度比空气大,所以应该用向上排空气的方法来收集,而氯气有毒,所以多余的尾气要用碱性溶液吸收处理,因此正确的应该是C;②检验是否有氯气生成可采用的方法是用湿润的淀粉碘化钾试纸,试纸会变为蓝色;或将气体通入硝酸银溶液产生白色沉淀,因此选项是C、D;③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;④ 如图所示,往漂粉精溶液中持续通入SO2 的过程中,可观察到的现象有溶液中先出现浑浊,最后产生大量白色沉淀;溶液颜色由无色变为黄绿色最后黄绿色褪去;液面上方出现白雾等。
2NaOH+H2↑+Cl2↑;(3)①由于氯气的密度比空气大,所以应该用向上排空气的方法来收集,而氯气有毒,所以多余的尾气要用碱性溶液吸收处理,因此正确的应该是C;②检验是否有氯气生成可采用的方法是用湿润的淀粉碘化钾试纸,试纸会变为蓝色;或将气体通入硝酸银溶液产生白色沉淀,因此选项是C、D;③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;④ 如图所示,往漂粉精溶液中持续通入SO2 的过程中,可观察到的现象有溶液中先出现浑浊,最后产生大量白色沉淀;溶液颜色由无色变为黄绿色最后黄绿色褪去;液面上方出现白雾等。
考点:考查粗盐的提纯方法、电解饱和NaCl溶液的反应原理、氯气的收集、检验、性质及尾气处理的知识。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:实验题
(16分)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为
。
(3)完成煅烧中的化学方程式: CuO + Al2O3  CuAlO2 + ↑
CuAlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:选择题
下列说法正确的是:
A.石油分馏和煤的干馏都是物理变化
B.塑料和蚕丝都是天然高分子化合物
C.淀粉和纤维素水解的最终产物都是葡萄糖
D.易溶于汽油、酒精、苯的物质一定是有机物
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
在1 L定容的密闭容器中,可以证明可逆反应N2 + 3H2 2NH3 已达到平衡状态的是
2NH3 已达到平衡状态的是
A.c(N2):c(H2):c(NH3)= 1 : 3 : 2
B.一个N≡N 断裂的同时,有3个H—H生成
C.其他条件不变时,混合气体的密度不再改变
D.v正(N2)= 2 v逆(NH3)
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象,得出的结论正确的是
| 操 作 | 现 象 | 结 论 |
A | 测定等浓度的Na2CO3和Na2SO4 溶液的pH | 前者pH比后者的大 | 非金属性: |
B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 |
D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:填空题
(21分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
 (5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、______晶体
(7)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。
 (8)用电子式表示B的硫化物的形成过程:_____________________________________
(8)用电子式表示B的硫化物的形成过程:_____________________________________
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸
D.气态氢化物的稳定性:HmY小于HmX
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
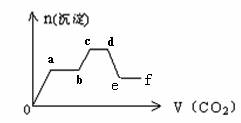
A.o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B.b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32-
C.a—b段与c—d段所发生的反应相同
D.d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com