
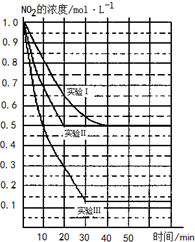
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:| c2(NO)?c(O2) |
| c2(NO2) |
| 0.52×0.25 |
| 0.52 |
| (0.5+0.5)2×0.25 |
| (0.5+0.5)2 |
| m |
| n |


科目:高中化学 来源: 题型:
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、生铁比软铁心(几乎是纯铁)容易生锈 |
| C、铁制器件附有铜质配件,在接触处易生锈 |
| D、铁丝在纯氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=
Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
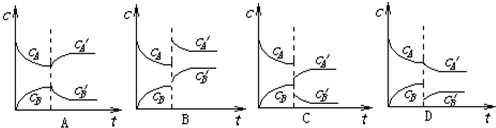
| 序号 | 平衡移动的因素 | 平衡移动的方向(填“逆反应方向”或“正反应方向”) |
| A | ||
| B | ||
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要长时间储存的食品应加入适宜的防腐剂 |
| B、冰激凌不使用着色剂营养价值一定会降低 |
| C、炒菜时拒绝添加食盐、味精等各种调味剂 |
| D、色、香、味俱全的食物营养价值不一定高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com