
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32-
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42-
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学(文)试卷(解析版) 题型:选择题
改革开放以来,祖国越来越富强,人民生活水平不断提高,不合理的饮食习惯严重影响身体健康,下列饮食习惯科学的是
A.多吃肉,少吃蔬菜水果
B.合理摄入糖类、油脂等,注意膳食平衡
C.为防止变胖,炒菜时不放油
D.多饮用纯净水,少饮用矿泉水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液加入溴水后,溴被还原,由此推断该溶液中
A.不含NO3-,也不含Fe3+ B.含有NO3-、I-、Cl-
C.含I-,不含Cl- D.含有Fe3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:

其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | CO2 |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
(14分)铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。回答下列问题。
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是________________。
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)______________________
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为 ______,该氧化物中的Fe分别为Fe2+、Fe3+,计算n(Fe2+):n(Fe3+)= _________
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2  Cu,②CuO
Cu,②CuO  CuSO4
CuSO4  Cu。
Cu。
若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是__________
A.相等 B.①多 C.②多 D.无法判断
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1________(填“大于”、“可能大于”、“等于”或“可能等于”)m2
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为_______mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:填空题
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为 mol/L(假设电解前后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
往含等物质的量的偏铝酸钠与氢氧化钠的混合溶液中通入二氧化碳,产生沉淀的量与通入二氧化碳的量关系正确的是


查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(12分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3?2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质。以其为原料制取硫酸铜的工艺流程如下图所示:
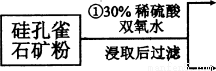
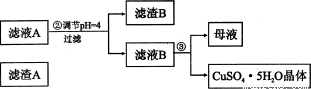
(1)步骤1中先加入足量稀硫酸,再加人双氧水。则双氧水参与该反应的离子方程式是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是________。(填字母编号)
A.A12O3 B.CuO C.CuCO3·Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
则滤液B中含有的阳离子是__________________________。
(4)将滤液B通过_______、________、过滤等操作可得到硫酸铜晶体。
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是______________。取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol。则a=__________。(氧气占空气体积的五分之一)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:填空题
(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
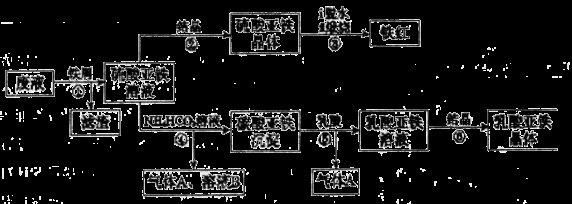
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
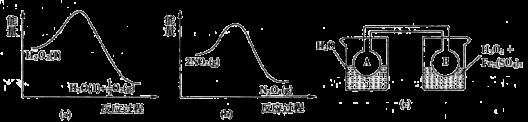
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com