
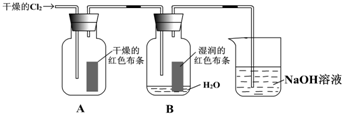
(7分)为了探究HClO的漂白性,某同学设计了如下的实验。

(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;从集气瓶B中湿润的红色布条的现象可得出的结论是 ,其中发生的反应的化学方程式为 。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
(3)烧杯中溶液所起的作用是 ,烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为__________mL。
(1) 干燥的Cl2没有漂白性, 氯水有漂白性 Cl2+ H2O=HCl+ HClO。
(2) 验证HCl是否有漂白性
(3) 吸收多余的Cl2, Cl2+2NaOH=NaCl+ NaClO+H2O 。 (4)200ml
【解析】(1)干燥放热有色布条不褪色,说明干燥的Cl2没有漂白性。B中湿润的红色布条褪色,则说明氯水有漂白性,这是由于氯气溶于水生成次氯酸具有氧化性,反应式为Cl2+ H2O=HCl+ HclO。
(2)由于氯气和水反应,还生成氯化氢,所以还必须验证HCl是否有漂白性。
(3)氯气有毒,所以必须进行尾气处理,所以氢氧化钠是吸收多余的氯气的,方程式为Cl2+2NaOH=NaCl+ NaClO+H2O。
(4)4分钟内通过的氯气是1.12L
|


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探究HClO的漂白性,某同学设计了如下的实验.
为了探究HClO的漂白性,某同学设计了如下的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com