
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
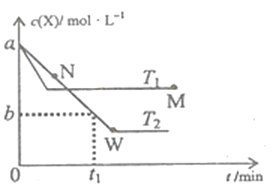
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
【答案】D
【解析】分析:用“先拐后平”法,T1优先T2出现拐点,T1达到平衡时间短、速率快,则T1![]() T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,该反应的ΔH
T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,该反应的ΔH![]() 0;利用图像上的数据和速率之比等于化学计量数之比计算υ(Y);平衡后再加入一定量X,相当于增大压强,平衡向正反应方向移动,X的平衡转化率增大。
0;利用图像上的数据和速率之比等于化学计量数之比计算υ(Y);平衡后再加入一定量X,相当于增大压强,平衡向正反应方向移动,X的平衡转化率增大。
详解:用“先拐后平”法,T1优先T2出现拐点,T1达到平衡时间短、速率快,其它条件不变时升高温度化学反应速率加快,则T1![]() T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,逆反应为吸热反应,该反应的ΔH
T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,逆反应为吸热反应,该反应的ΔH![]() 0。A项,M点是T1时的平衡点,υ正(M)=υ逆(M),N点是T2时的不平衡点,N点时的逆反应速率小于T2平衡时的逆反应速率,由于T1
0。A项,M点是T1时的平衡点,υ正(M)=υ逆(M),N点是T2时的不平衡点,N点时的逆反应速率小于T2平衡时的逆反应速率,由于T1![]() T2,T2平衡时的反应速率小于T1平衡时的反应速率,M点的正反应速率υ正大于N点的逆反应速率υ逆,A项错误;B项,T2下,0~t1时间内υ(X)=
T2,T2平衡时的反应速率小于T1平衡时的反应速率,M点的正反应速率υ正大于N点的逆反应速率υ逆,A项错误;B项,T2下,0~t1时间内υ(X)=![]() =
=![]() =
=![]() mol/(L·min),不同物质表示的化学反应速率之比等于化学计量数之比,υ(Y)=
mol/(L·min),不同物质表示的化学反应速率之比等于化学计量数之比,υ(Y)=![]() υ(X)=
υ(X)=![]() mol/(L·min),B项错误;C项,M点时再加入一定量X,相当于增大压强,平衡向正反应方向移动,平衡后X的转化率增大,C项错误;D项,该反应的正反应为放热反应,W点消耗X的物质的量大于M点,该反应进行到M点放出的热量小于进行到W点放出的热量,D项正确;答案选D。
mol/(L·min),B项错误;C项,M点时再加入一定量X,相当于增大压强,平衡向正反应方向移动,平衡后X的转化率增大,C项错误;D项,该反应的正反应为放热反应,W点消耗X的物质的量大于M点,该反应进行到M点放出的热量小于进行到W点放出的热量,D项正确;答案选D。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】碲锌镉(TeZnCd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中不正确的是
A. 它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔、沸点
B. 它易导电、导热,具有延展性
C. 它的熔、沸点比Zn的低
D. 它的硬度和强度比Cd的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的序号填在横线上:
A.萃取法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法
①分离NaCl溶液与沙子的混合物__;
②分离水和汽油的混合物__;
③分离互溶的四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物__;
④从碘的水溶液中提取碘__;
⑤从硫酸钾溶液中得到硫酸钾固体__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在呼吸面具中做供氧剂 ④铁丝在氯气中燃烧生成棕黄色的FeCl3 ⑤钠、氢气在氯气中燃烧都能产生白烟
A.①②B.②③C.③④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.“低碳生活”有利于减缓全球气候变暖和环境恶化的速度
B.光导纤维的主要材料是晶体硅
C.云、雾、烟均能产生丁达尔现象
D.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中列出了有关晶体的说明,错误的是( )
选项 | A | B | C | D |
晶体名称 | 氯化钾 | 氩 | 白磷(P4) | 烧碱 |
构成晶体微粒名称 | 阴、阳离子 | 原子 | 分子 | 阴、阳离子 |
晶体中存在的作用力 | 离子键 | 共价键、范德华力 | 共价键、范德华力 | 离子键、共价键 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用烃A合成高分子化合物N的流程如下图: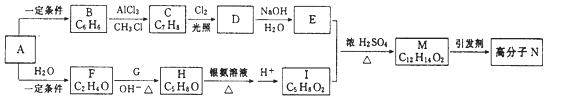
经测定烃A在标准状况下的密度为1.16g·L-1 , F和G是同系物,核磁共振氢谱显示有机物H中有四种峰,且峰值比为3:3:1:1。
已知:Ⅰ. 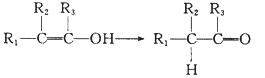
Ⅱ. ![]()
Ⅲ. 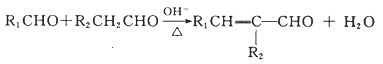 (R1、R2、R3代表烃基或氢原子)。
(R1、R2、R3代表烃基或氢原子)。
回答下列问题:
(1)写出A的结构简式:。
(2)H中所含官能团的名称是。
(3)H→I、M→N的反应类型分别是、。
(4)写出F和G反应生成H的化学方程式。
(5)E和I反应生成M的化学方程式为。
(6)芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成2-丙醇,则Q的种类有种。(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为:I2+2Na2S2O32NaI+Na2S4O6,下列说法合理的是( )
A. 该滴定可选用如图所示装置示剂;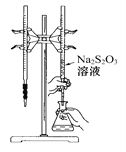
B. 该滴定可用甲基橙作指;
C. Na2S2O3是该反应的还原剂;
D. 该反应中每消耗2 mol Na2S2O3,电子转移数为4 mol;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是动植物生长不可缺少的元素,氨在自然界中的循环对生命有重要意义。其循环示意图如下:
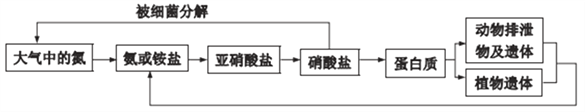
(1) 氨分子的电子式是__________。
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=_______kJ/mol
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是__________[填c(NH3·H2O)或c(NH4+)]该温度下NH3·H2O 电离平衡常数为___________(用a 的代数式表示)。
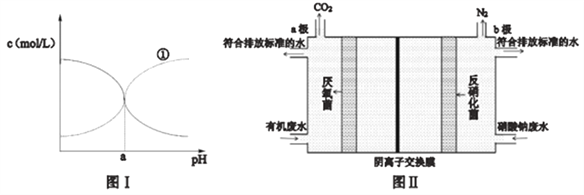
(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式__________________。
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g)![]() 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
时间/min | 0 | 5 | 10 | 20 | 40 | 80 |
容器 容积/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
该条件下达平衡时H2的转化率α(H2)=______,平衡常数K=_________(用V表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com