
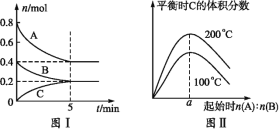
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图1表示200℃时容器中A、B、C的物质的量随时间的变化关系,图2表示不同温度下达到平衡时C的体积分数随起始
zC(g),图1表示200℃时容器中A、B、C的物质的量随时间的变化关系,图2表示不同温度下达到平衡时C的体积分数随起始![]() 的变化关系。则下列结论正确的是( )
的变化关系。则下列结论正确的是( )
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B.由图2可知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图1所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2molA和1molB,达到平衡时,A的体积分数小于0.5
【答案】D
【解析】
A.根据图示可知,反应从开始到平衡B在5min内物质的量改变了0.2mol,反应在2L容器内进行,则反应的平均速率v(B)=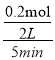 =0.02mol·L-1·min-1,A错误;
=0.02mol·L-1·min-1,A错误;
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,根据平衡移动原理,升高温度平衡向吸热反应移动,所以该反应的正反应为吸热反应,即△H>0;图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,即a=2,B错误;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y:z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A的体积分数为![]() =0.5,200℃时,向容器中充入2 mol A 和1 mol B,增大压强,平衡向正反应移动,故达到平衡时,A的体积分数小于0.5,D正确;
=0.5,200℃时,向容器中充入2 mol A 和1 mol B,增大压强,平衡向正反应移动,故达到平衡时,A的体积分数小于0.5,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】下列关于反应速率的说法中,正确的是
A.决定化学反应速率的因素是反应物本身的性质
B.对反应C(s)+CO2(g)![]() 2CO(g),其他条件不变时,增加C的量能使反应速率增大
2CO(g),其他条件不变时,增加C的量能使反应速率增大
C.其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
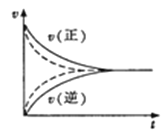
D.如图实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是引起“温室效应”的主要物质,对其有效的回收利用,不仅能缓解能源危机,又可减少温室效应的影响,具有解决能源问题和环保问题的双重意义。
(1)![]() 和
和![]() 经过催化重整可以得到合成气(
经过催化重整可以得到合成气(![]() 和
和![]() );
);
![]()
①一定温度和压强下,由元素最稳定的单质生成![]() 纯化合物时的反应热称为该化合物的标准摩尔生成焓。已知
纯化合物时的反应热称为该化合物的标准摩尔生成焓。已知![]() 、
、![]() 、
、![]() 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为![]() 、
、![]() 、
、![]() 。则上述重整反应的
。则上述重整反应的![]() ________
________![]() 。
。
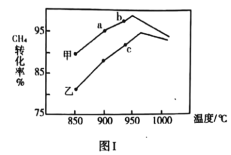
②其他条件相同,甲、乙两种不同催化剂作用下,相同时间内测得![]() 转化率
转化率![]() 与温度变化关系如图Ⅰ,
与温度变化关系如图Ⅰ,![]() ________(填“可能一定”或“一定未”)达到平衡状态理由是________。
________(填“可能一定”或“一定未”)达到平衡状态理由是________。
(2)![]() 与
与![]() 可以用来生产尿素
可以用来生产尿素![]() ,其反应过程为:
,其反应过程为:![]() ;
;
①![]() 时,在
时,在![]() 的密闭容器中充人
的密闭容器中充人![]() 和
和![]() 模拟工业生产。投料比
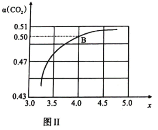
模拟工业生产。投料比![]() ,如图Ⅱ是
,如图Ⅱ是![]() 平衡转化率
平衡转化率![]() 与
与![]() 的关系。则图中
的关系。则图中![]() 点
点![]() 的平衡转化率
的平衡转化率![]() _______。
_______。
②当![]() 时,若起始的压强为
时,若起始的压强为![]() ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的![]() 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数![]() ________
________![]() 。
。
(3)以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
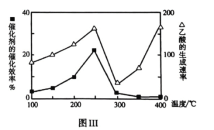
①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。250-300℃时,温度升高而乙酸的生成速率降低的原因是________。
②为了提高该反应中![]() 的转化率,可以采取的措施是________。
的转化率,可以采取的措施是________。
(4)纳米二氧化钛膜中的![]() 电对吸附
电对吸附![]() 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入![]() 进行电解,在阴极可制得低密度聚乙烯
进行电解,在阴极可制得低密度聚乙烯![]() ,(简称
,(简称![]() )。电解时,
)。电解时,![]() 最终转化为
最终转化为![]() 的电极反应式是________。
的电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
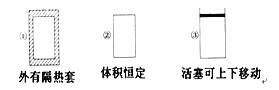
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为__。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1;当升高温度,该反应的平衡常数K__(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是__(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
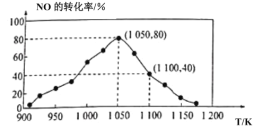
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数_(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =__(计算结果用分数表示)
=__(计算结果用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____(填“放热”或“吸热”)反应。
②乙容器在50min时达到平衡状态,则NO的浓度是______,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)_______Kc(C)(填“<”、“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
B.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
C.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
D.14g聚丙烯中含C—H键总数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列实验事实所得出的相应结论不正确的是( )
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01mol·L-1的酸性KMnO4溶液分别与0.1mol·L-1的H2C2O4溶液和0.2mol·L-1的H2C2O4溶液反应,后者退色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和硫酸溶液的混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,相同温度下发生如下反应:H2(g)+I2(g) | 当其他条件不变时,纯气态反应体系的压强越大,化学反应速率越快 |
D | 将少量MnO2粉末加入盛有10%H2O2溶液的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生变化 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(![]() )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为![]() )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 的
的![]() ________(用含
________(用含![]() 、
、![]() 、
、![]() 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应![]() 。
。
①下列说法正确的是________(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加![]() 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时![]() 的浓度为1.4 mol·L1,充入一定量的
的浓度为1.4 mol·L1,充入一定量的![]() ,反应再次达到平衡,
,反应再次达到平衡,![]() 浓度________(填“
浓度________(填“![]() ”“
”“![]() ”或“
”或“![]() ”) 1.4 mol·L1。
”) 1.4 mol·L1。
⑶在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,若仅发生反应:
,若仅发生反应: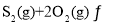
![]() ,
,![]() 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则![]() 内,
内,![]() 的反应速率为________
的反应速率为________![]() 。
。
⑷在恒容密闭容器中,加入足量的![]() 和
和![]() ,仅发生反应:
,仅发生反应:![]()
![]()
![]() 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
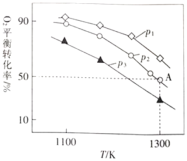
①![]() ________(填“
________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)0;比较
”)0;比较![]() 、
、![]() 、
、![]() 的大小:________。
的大小:________。
②若初始时通入![]() ,
,![]() 为
为![]() ,则
,则![]() 点平衡常数
点平衡常数![]() ________(用气体平衡分压代替气体平衡浓度计算,分压
________(用气体平衡分压代替气体平衡浓度计算,分压![]() 总压
总压![]() 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com