
分析 (1)将方程式$\frac{I+II+III}{2}$得N2H4(l)+O2(g)=N2(g)+2H2O(g)△H4=$\frac{△{H}_{1}+△{H}_{2}+△{H}_{3}}{2}$,K4=$\sqrt{{K}_{1}.{K}_{2}.{K}_{3}}$;
(2)v(NO)=$\frac{△c(NO)}{△t}$=$\frac{0.04mol/L}{2h}$=0.02mol/(L.h),反应速率之比等于计量数之比,据此计算氧气反应速率;
N2(g)+02(g)?2NO(g)
开始(mol/L)1.0 1.0 0
反应(mol/L)0.02 0.02 0.04
平衡(mol/L)0.98 0.98 0.04
氮气转化率=$\frac{0.02mol/L}{1.0mol/L}×100%$;
化学平衡常数K=$\frac{0.0{4}^{2}}{0.9{8}^{2}}$;
在该温度下,向容积为10L的密闭容器中通入2.94×10-3mol NO,2.50×10-1molN2,4.00×10-2mol O2,则c(NO)=2.94×10-4mol/L、c(N2)=2.50×10-2mol/L、c(O2)=4.00×10-3mol/L,根据浓度商和化学平衡常数相对大小判断反应方向;
(3)二者恰好反应生成强酸弱碱盐,弱离子阳离子水解导致溶液呈酸性,根据电荷守恒判断离子浓度大小顺序.
解答 解:(1)将方程式$\frac{I+II+III}{2}$得N2H4(l)+O2(g)=N2(g)+2H2O(g)△H4=$\frac{△{H}_{1}+△{H}_{2}+△{H}_{3}}{2}$,K4=$\sqrt{{K}_{1}.{K}_{2}.{K}_{3}}$,
故答案为:$\sqrt{{K}_{1}.{K}_{2}.{K}_{3}}$;=$\frac{△{H}_{1}+△{H}_{2}+△{H}_{3}}{2}$;
(2)v(NO)=$\frac{△c(NO)}{△t}$=$\frac{0.04mol/L}{2h}$=0.02mol/(L.h),反应速率之比等于计量数之比,则v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×0.02mol/(L.h)=0.01mol/(L.h);
N2(g)+02(g)?2NO(g)
开始(mol/L)1.0 1.0 0
反应(mol/L)0.02 0.02 0.04
平衡(mol/L)0.98 0.98 0.04
氮气转化率=$\frac{0.02mol/L}{1.0mol/L}×100%$=2%;
化学平衡常数K=$\frac{0.0{4}^{2}}{0.9{8}^{2}}$=0.0017;
在该温度下,向容积为10L的密闭容器中通入2.94×10-3mol NO,2.50×10-1molN2,4.00×10-2mol O2,则c(NO)=2.94×10-4mol/L、c(N2)=2.50×10-2mol/L、c(O2)=4.00×10-3mol/L,浓度商=$\frac{2.94×1{0}^{-4}×2.94×1{0}^{-4}}{2.5×1{0}^{-2}×4×1{0}^{-3}}$=8.6×10-4<K,则平衡正向移动;
故答案为:0.01;2%;0.0017;b;
(3)二者恰好反应生成强酸弱碱盐,溶液中氢离子全部来自于水电离,所以该溶液中水电离出的c(H+)=10-6mol/L,弱离子阳离子水解导致溶液呈酸性,则c(H+)>c(OH-),盐类水解较微弱,根据电荷守恒得c(N2H5+)<c(Cl-),则离子浓度大小顺序是c(Cl-)>c(N2H5+)>c(H+)>c(OH-),
故答案为:10-6;c(Cl-)>c(N2H5+)>c(H+)>c(OH-).
点评 本题考查较综合,涉及盐类水解、化学平衡常数有关计算、盖斯定律等知识点,为高频考点,难点是平衡移动方向判断,注意利用浓度商与化学平衡常数相对大小判断反应方向,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | (a+b+c)L | B. | 2(a+b+c)L | C. | (a+b+2c)L | D. | 3(a+b+c)L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
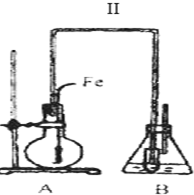 色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.
色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
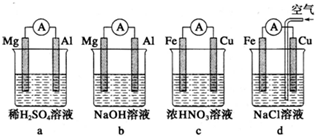
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 取含HCl和MgSO4的混合溶液1L,逐滴加入1mol•L-1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图:
取含HCl和MgSO4的混合溶液1L,逐滴加入1mol•L-1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
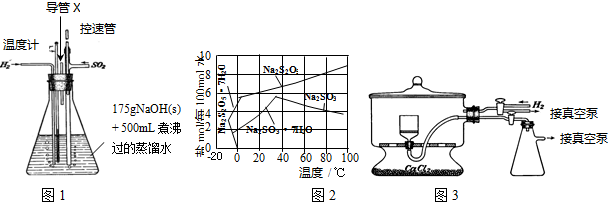
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com