
| A. | CO2的电子式为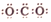 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
分析 A.二氧化碳分子中含有两个碳氧双键,不是碳氧单键;
B.浓硫酸具有很强腐蚀性,图示为易燃标志;
C.分散系分类依据为分散质粒子直径大小;
D.元素符号的左上角为质量数,该碳原子的质量数为14.
解答 解:A.二氧化碳是碳原子和氧原子之间通过共价双键形成的非极性分子,电子式为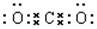 ,故A错误;
,故A错误;
B.浓硫酸具有强烈的腐蚀性,浓硫酸包装上应贴上腐蚀品标志,图中所示标志为易燃标志,故B错误;
C.按分散质粒子直径大小可将分散系分为溶液、浊液和胶体,故C正确;
D.核内含8个中子的碳原子的质量数为14,其正确的表示方法为:146C,故D错误;
故选C.
点评 本题考查据此化学用语的表示方法,题目难度不大,涉及电子式、元素符号、危险品标志、分散系分类等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 乙醇、苯和溴苯用水即可鉴别 | ||
| C. | 汽油、柴油、植物油都是碳氢化合物 | D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5倍 | B. | 4倍 | C. | 3 倍 | D. | 2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
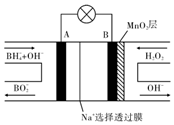 新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从B极区移向A极区 | |
| C. | 电池负极的电极反应为:BH4+8OH--8e一═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的方法有蒸馏法、离子交换法、电渗析法等 | |
| B. | 明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌 | |
| C. | Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐” | |
| D. | 与铜质水龙头连接处的铜质水管不易发生腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| B. | C4H8C12有9种同分异构体(不考虑立体异构) | |
| C. | 石蜡油、苯、四氟乙烯都不能使溴水褪色 | |
| D. | 等物质的量的甲烷与氯气反应后体积保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
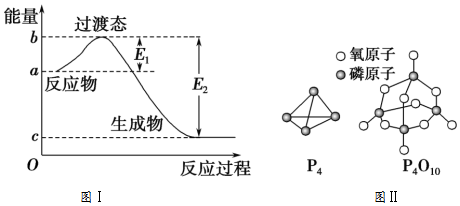
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/(kJ/mol) | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
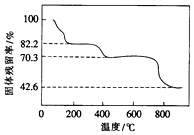 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.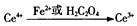
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com