
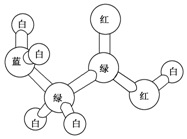
 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 乙醇钠 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
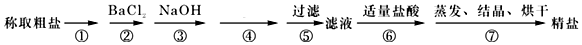
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 晶体硅 | S |
| C | CH3COONa | 水晶 |  |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | Al2H6中铝的杂化方式为sp3杂化 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为三氧化二铝和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含有离子键 | |
| B. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| C. | 化学键存在于分子之间 | |
| D. | 共价化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: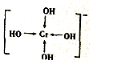 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水:Fe3+、NH4+、SO42-、OH- | |
| B. | 加入过量NaClO溶液:Fe2+、H+、Cu2+、SO42- | |
| C. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| D. | 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com