
【题目】某澄清溶液中可能含有Na+、K+、NH4+、Mg2+、Fe2+、SO42﹣、SO32﹣、Cl﹣、I﹣、CO32﹣中的若干种,且离子浓度都相等。现取该溶液进行有关实验,实验结果如下图所示:
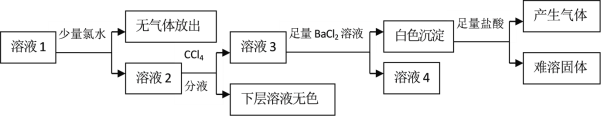
下列关于该溶液的说法中正确的是
A.通过CCl4层无色可以推知原溶液中一定不存在I-
B.向白色沉淀中加入盐酸产生气体并留有难溶固体可推知原溶液中存在SO32﹣和CO32-
C.该溶液中不可能同时存在NH4+和Cl-
D.另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则可确定原溶液中所有离子的存在情况
【答案】D
【解析】
溶液1中加入少量氯水,无气体放出,说明溶液中不含CO32﹣,因还原性SO32﹣> I-,加入少量的氯水,应先氧化SO32﹣,下层溶液无色,不能确定原溶液中是否含有I-,氯水将SO32﹣氧化为SO42﹣,但量太少,可能只部分氧化,溶液3中加入足量氯化钡溶液产生白色沉淀为亚硫酸钡和硫酸钡,沉淀加入足量盐酸时亚硫酸钡溶解,硫酸钡不溶;SO32﹣与Mg2+、Fe2+不能大量共存,则原溶液中不存在Mg2+、Fe2+;原溶液中各离子浓度都相等,根据电荷守恒,Na+、K+、NH4+至少存在其中的两种,一定无SO42﹣,可能有I-,据此分析。
A. 因还原性SO32﹣> I-,溶液1中加入少量的氯水,应先氧化SO32﹣,故通过CCl4层无色不能推知原溶液中不一定存在I-,选项A错误;
B. 溶液1中加入少量氯水,无气体放出,说明溶液中不含CO32﹣,选项B错误;
C. 根据电荷守恒,Na+、K+、NH4+至少存在其中的两种,且存在SO32﹣,若阳离子Na+、K+、NH4+存在,则存在NH4+和Cl-,选项C错误;
D. 另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则不含NH4+,原溶液中所有离子为Na+、K+、SO32﹣,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种漂白、消毒、增氧剂,常温下为白色晶体,易于贮运,一般条件下不易分解,可用30%的双氧水和饱和尿素溶液在一定条件下来合成。
实验原理:CO(NH2)2+H2O2![]() CO(NH2)2·H2O2
CO(NH2)2·H2O2
实验装置:实验室模拟制取装置如图1所示(部分仪器未画出)。
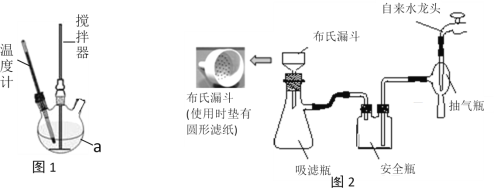
实验步骤:
步骤一:在250mL的仪器a中加入100mL30%的过氧化氢溶液,再加1 g NaH2PO4作稳定剂,开启搅拌器,通过仪器a右端瓶口缓慢加入50 g尿素,全部溶解后,控制温度在30℃左右,搅拌反应30分钟。
步骤二:将仪器a中的溶液用普通漏斗过滤,将滤液冷却到0℃,析出大量晶体,抽滤,烘干即得产品。
回答下列问题:
(1)仪器a 的名称是____________,制取过程中需控制n(H2O2):n[CO(NH2)2] =1.2 :1左右,并控制合成温度在30℃左右,其主要原因是__________________________________,控制反应温度的加热方法是________________。
(2)实验室一般用玻璃而非铁质搅拌器的原因是____________________________________。而实际生产中搅拌器选用的是铁质材料,但需将搅拌装置放在__________________(填试剂名称)中浸泡一段时间,使其表面钝化。
(3)①步骤二中“抽滤”按图2安装好装置,在布氏漏斗中放入滤纸,接下来的操作顺序是____________________→确认抽干(填标号)
a. 转移固液混合物 b. 开大水龙头 c. 微开水龙头 d. 加入少量蒸馏水润湿滤纸
②与用普通漏斗过滤相比,抽滤的主要优点是______________________________。
(4)过氧化尿素鉴定反应:在重铬酸钾酸性溶液中加入乙醚和少许过氧化尿素,振荡。上层乙醚呈蓝色,这是由于在酸性溶液中过氧化尿素中的过氧化氢与重铬酸钾反应生成较稳定的蓝色过氧化铬(CrO5:![]() ),重铬酸钾与H2O2反应的离子方程式为_______________。
),重铬酸钾与H2O2反应的离子方程式为_______________。
(5)过氧化尿素的合格产品中H2O2 的质量分数应不低于34%。为了确定某次实验产品合格与否,称取了该次样品12.0000g,溶于水配制成250mL溶液。移取25.00mL溶液于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。终点颜色变化为_____________。根据滴定结果通过计算判断该次实验产品质量为___________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁是重要的还原剂。常用于检测硒,生产氯化铁、聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。已知:

请回答下列问题:
(1)在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,___、___固液分离,洗涤,快速干燥制得。
(2)如图,用H2还原无水FeCl3制取FeCl2。

①图A是用干燥的Cl2和铁粉制取无水FeCl3的装置。硬质玻璃管和收集器用大口管连接的原因是____。
②装置B、C、D、E是用H2还原无水FeCl3制取FeCl2的装置。连接顺序为(可重复使用)___,仪器C中盛放的试剂是___。
(3)按如图所示装置,用162.5g无水氯化铁和225g氯苯,控制反应温度加热3h。冷却,分离提纯得到粗产品。反应为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。

①仪器B的作用是___;C中倒挂漏斗的作用是___。
②反应的温度最好控制在132℃左右。则最佳的加热方式为___(填序号)。
A.直接用酒精灯加热 B.隔石棉网用酒精灯加热
C.水浴加热 D.油浴加热
③通过烧杯C现象变化可以监控氯化铁的转化率。若烧杯C中试剂为加有酚酞且含18gNaOH的溶液,则氯化铁转化率理论上达到或超过___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙烯氧化成乙醛的反应,可设计成如图所示的电化学装置,下列说法不正确的是
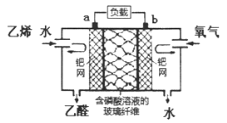
A.该电化学装置是原电池装置
B.电子移动方向:电极a→负载→电极b→磷酸溶液→电极a
C.a极反应式可表示为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D.当b极消耗标准状况下氧气5.6L时,理论上玻璃纤维中有NA个H+从左往右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。
(1) Co基态原子核外电子排布式为_________,第二周期元素第一电离能比B高的有______种;
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2中的化学键除了σ键外,还存在______;
(3)NaBO2可用于织物漂白。BO2-的空间构型为_______写出两种与其互为等电子体的分子的化学式:_______;
(4)下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数);

下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为________;

(5)立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为_______________;
(6)一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,该晶体的密度为__gcm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.18O 31P 119Sn
B.27Al 19F 12C
C.元素周期表中第一周期所有元素的原子
D.元素周期表中第ⅤA族所有元素的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_______。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒、______,操作I、II的名称依次是抽滤、________。
(3)操作Ⅲ的主要过程可能是___________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是___________,装置F中盛放的物质是____________。
a、浓硫酸 b、无水硫酸铜 c、无水CaCl2 d、碱石灰
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是____________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与__________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A. 80目、100分钟、50℃
B.60目、120分钟、50℃
C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了监测某烟道气中的NOx的含量,选用如下采样和检测方法。

I.采样步骤
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用是___。采样步骤②加热烟道气的目的是___。
C中填充的干燥剂最好的选择是___(选填编号)。
a.碱石灰 b.无水CuSO4 c.P2O5
(2)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂___。

Ⅱ.NOx含量的测定
将一定量的气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,然后加入过量的FeSO4标准溶液,充分反应后,再用K2Cr2O7标准溶液滴定剩余的Fe2+。
(3)NO被H2O2氧化为NO3-的离子方程式是___。滴定操作使用的玻璃仪器主要有___。
(4)滴定过程中发生下列反应:3Fe2++NO3+4H+=NO↑+3Fe3++2H2O、Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O。判断下列情况对NOx含量测定结果的影响(填“偏高”、“偏低”或“无影响”):若缺少采样步骤③,会使测试结果___;若FeSO4标准溶液部分变质,会使测定结果___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com