
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
分析 被氧化的氨气生成N2,根据原子守恒计算氮气的物质的量,再根据方程式计算氯气的物质的量,进而计算参加反应氯气的体积.
解答 解:10.2g氨气的物质的量=$\frac{10.2g}{17g/mol}$=0.6mol,氨气被氧化生成氮气,根据N原子守恒可知生成氮气的物质的量=$\frac{0.6mol}{2}$=0.3mol,由方程式8NH3+3Cl2═6NH4Cl+N2可知参加反应氯气为0.3mol×3=0.9mol,故参加反应氯气的体积=0.9mol×22.4L/mol=20.16L,
故选C.
点评 本题考查化学方程式的有关计算、氧化还原反应有关计算,难度不大,利用电子转移守恒计算氯气的物质的量更简单.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯与溴水(加成反应) | B. | 苯与液溴(取代反应) | ||
| C. | 乙醇与乙酸的酯化反应(取代反应) | D. | 乙醇与氧气(取代反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J |
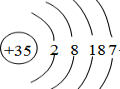 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 | |
| D. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:④>①>②>③ | B. | 原子半径:①>③>②>④ | ||
| C. | 电负性:④>③>②>① | D. | 最高正化合价:④=①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com