
| A、常温常压下,16g O3气体含有氧原子数为NA |
| B、标准状况下,44.8 L三氯甲烷含有的分子数为NA |
| C、1molFe与足量稀硝酸反应,转移的电子数为2NA |
| D、1L 0.1mol?L-1氨水中含有0.1NA个OH- |


科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH 用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3+H+ 明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?x H2O↓+4HCl 用TiCl4制备TiO2 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过渡元素形成的化合物 |
| B、第IIIA族元素形成的化合物 |
| C、第VIIA族元素形成的化合物 |
| D、第IVA族元素形成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫原子的原子结构示意图: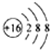 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液中肯定不含Mg2+、SiO32- |
| B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- |
| C、原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成 |
| D、原溶液中一定含有Mg2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com