
| A. | 发生的反应都是置换反应 | B. | 实验所得滤液是纯水,可直接排放 | ||
| C. | 滤渣中一定含铜和锌 | D. | 反应前后液体的酸性减弱,pH变小 |
分析 根据金属活动性顺序表可知,锌和稀硫酸及硫酸铜都能发生置换反应,生成物中有硫酸锌和铜以及氢气,如果反应物的量不同,反应后剩余的物质就不一样.
解答 解:A、锌和稀硫酸及硫酸铜都能发生置换反应,分别生成氢气和Cu,故A正确;
B、因为锌和稀硫酸及硫酸铜都能发生反应,生成物中有硫酸锌和铜以及氢气,所以滤液中的溶质主要是硫酸锌,不是纯水,故B错误;
C、滤渣中一定含铜,可能含有锌,如果锌的量比较少,没有使酸和硫酸铜完全反应,滤渣中就没有锌,此故C错误;
D、反应消耗氢离子,则溶液的酸性减弱,pH增大,故D错误.
故选A.
点评 本题考查了金属的性质、置换反应的概念、溶液酸碱性与pH的关系,题目难度不大,主要把握置换反应的概念.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 下图是盐酸与氢氧化钠溶液的滴定曲线a和b.
下图是盐酸与氢氧化钠溶液的滴定曲线a和b.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
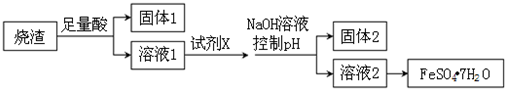
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| B. | 标准状况下,2.24L水的质量是1.8g | |
| C. | 16gO3比16gO2所含的氧原子数多 | |
| D. | 22gCO2与标准状况下11.2L Cl2含有相同的分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com