

分析 由元素在周期表的位置可知,①~⑩分别为H、Na、K、Mg、Al、C、O、Cl、I、Fe,
(1)C原子结构中有2个电子层,最外层电子数为4;
(2)具有相同电子排布的离子中,原子序数大的离子半径小;
(3)Fe的原子序数为26,Fe与盐酸反应生成氯化亚铁和氢气;
(4)⑥与⑧形成化合物为四氯化碳,碘不易溶于水,易溶于有机溶剂;
(5)由“元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它跟氢生成的氢化物的化学式为RH3,根据氢化物中含氢为8.82%,可以计算出R的相对原子质量.
解答 解:由元素在周期表的位置可知,①~⑩分别为H、Na、K、Mg、Al、C、O、Cl、I、Fe,
(1)C原子结构中有2个电子层,最外层电子数为4,则元素⑥位于元素周期表的第二周期第ⅣA族,故答案为:二;ⅣA;
(2)具有相同电子排布的离子中,原子序数大的离子半径小,则元素②、④和⑤的简单离子中半径最小的是Al3+,离子半径最大的是Na+,
故答案为:Al3+;Na+;
(3)元素⑩为Fe,其原子序数为26,Fe与盐酸反应生成氯化亚铁和氢气,离子反应为Fe+2H+=Fe2++H2↑,
故答案为:26;Fe+2H+=Fe2++H2↑;
(4)⑥与⑧形成化合物为四氯化碳,其化学式为CCl4,碘不易溶于水,易溶于有机溶剂,则该化合物将⑨单质从水溶液中提取出来的操作叫萃取,
故答案为:CCl4;萃取;
(5)由“元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它的氢化物的化学式为RH3,设R的相对原子质量为x,则$\frac{3}{3+x}$×100%=8.82%,解得:x=31,
故答案为:31.
点评 本题考查位置、结构、性质,为高频考点,把握元素在周期表的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀 | |
| B. | MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用热的纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
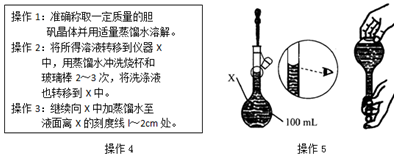
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则m+n<14 | |
| B. | 若a=b,则HX一定是弱酸 | |
| C. | 反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | 若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
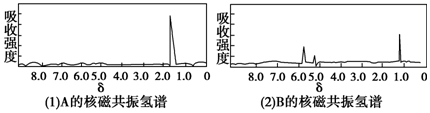
| A. | A是C3H8;B是C6H6 | B. | A是C4H10;B是C6H6 | ||
| C. | A是C3H6;B是C3H6 | D. | A是C3H6;B是C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质(杂质) | 试剂 | |
| A | CH4(SO2) | 酸性高锰酸钾溶液 |
| B | 氧化铁(氧化铝) | KOH溶液 |
| C | 氯化氢(氯气) | CCl4 |
| D | 溴苯(乙醇) | 苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com