

分析 (1)①评价实验方案要从反应的可操作性,生成物的性质,环保节能等方面分析.由于硝酸与铜直接反应时会生成有毒的氮氧化物,第一个方案环保并且使用的硫酸量较小进行分析;
②实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,分析装置可知,利用分液漏斗控制加入过氧化氢的量能达到要求;
(2)该反应中Fe元素化合价由0价变为+2价、Cu元素化合价由+2价变为0价,所以Fe作负极、不如Fe活泼的金属或导电的非金属作正极,如铜片或石墨,硝酸铜为电解质;工作时,正极反应式为Cu2++2e-=Cu,负极反应式为Fe-2e-=Fe2+,电子从负极沿导线流向正极;
根据1mol转移2mol的电子,来分析求解;
(3)铜是负极发生氧化反应,电极反应式为:Cu-2e-=Cu2+,铜如果是正极,电极反应式为:Cu2++2e-=Cu.
解答 解:(1)①甲方案中放出的有毒气体氮氧化物会造成对空气的污染,因此,从保护环境的角度来看,甲方案不合理;乙方案铜和氧气加热生成氧化铜,氧化铜和硝酸反应产生硝酸铜和水,因此反应过程中没有污染物,且原料的利用率高;
故答案为:乙;理由:a制取等量的硝酸铜所用硝酸的量少,减少对环境的污染;
②实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,分析装置可知,利用分液漏斗控制加入过氧化氢的量能达到要求,装置B中生成的氧气通过浓硫酸可以干燥氧气,同时观察气体气泡冒出的速率控制生成氧气的速率,所以选择B装置;
故答案为:B;
(2)该反应中Fe元素化合价由0价变为+2价、Cu元素化合价由+2价变为0价,所以Fe作负极、不如Fe活泼的金属或导电的非金属作正极,如铜或石墨,硝酸铜为电解质;工作时,正极反应式为Cu2++2e-=Cu,负极反应式为Fe-2e-=Fe2+;
Fe作负极、石墨作正极,硝酸铜为电解质,装置图为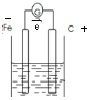 ;硝酸铜浓度变为原来一半时,则参加反应的铜离子的物质的量为:0.4L×2mol/L×$\frac{1}{2}$
;硝酸铜浓度变为原来一半时,则参加反应的铜离子的物质的量为:0.4L×2mol/L×$\frac{1}{2}$
=0.4mol,所以转移电子数为:0.8NA,故答案为:①负极:Fe;Fe-2e-=Fe2+;②正极:石墨;Cu2++2e-=Cu;③0.8NA;
(3)铜是负极发生氧化反应,电极反应式为:Cu-2e-=Cu2+,铜如果是正极,电极反应式为:Cu2++2e-=Cu,所以当电路中通过2mol电子时,Cu电极质量变化可能增重64g,也可能减重64g,故选C.
点评 本题考查了物质成分探究实验和电化学的相关知识,题目涉及的知识点比较多,分析一个反应的可行性要从多方面分析,如从反应的可行性,环保安全,操作简便,经济节能方面考虑,本题难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+H2O | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2-+2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 同周期主族非金属元素随原子序数递增,原子得电子能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与氢气加成: | |
| B. | 乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |
| C. | 从海带中提取碘:H2O2+I-+H+═I2+2H2O | |
| D. | 乙醇催化氧化:2CH3CH2OH+18O2 $→_{△}^{Cu}$ 2CH3COH+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲中盛硫酸锌溶液,乙中盛硫酸铜溶液,锌为阴极 | |
| B. | 乙中盛硫酸铜溶液,铜离子在铜电极上被氧化 | |
| C. | 电池工作时,盐桥中的阳离子移向甲,阴离子移向乙,溶液仍保持电中性 | |
| D. | 取出盐桥,电流表指针即回到零点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇(水):加新制的生石灰,过滤 | |
| B. | 溴苯(苯):加水,振荡静置后分液 | |
| C. | 乙烷(乙烯):通过溴水溶液,洗气 | |
| D. | 乙酸乙酯(乙酸):加NaOH溶液,振荡静置后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com