
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
分析 原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属,以此解答该题.
解答 解:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,
将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B.
金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C.
所以金属的活动性顺序为:D>A>B>C,
故选B.
点评 本题考查了金属活动性强弱的判断,难度不大,能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.4mol•L-1 | B. | 1.2mol•L-1 | C. | 1.1mol•L-1 | D. | 1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2++4Cl- | |
| D. | 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
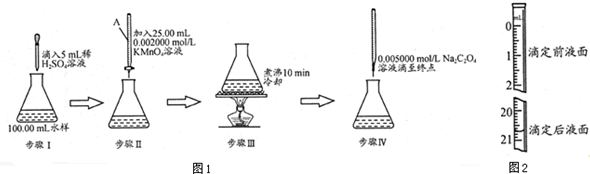
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生了砖红色沉淀,因黑色物质的遮盖而看不见 | |
| B. | 不可能产生砖红色沉淀,因为在加入少量新制备的Cu(OH)2前,没有把水解后的溶液调至碱性 | |
| C. | 蔗糖水解的最终产物不仅有葡萄糖,而且有果糖 | |
| D. | 产生的黑色物质可能是Cu(OH)2受热分解的产物CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Cl2═2KCl+I2 | B. | CaCO3═CaO+CO2↑ | ||
| C. | SO3+H2O═H2SO4 | D. | MgCl2+2NaOH═Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 若为电解饱和食盐水的装置,则a,b上均产生气体 | |
| B. | 若为工业冶炼铝的装置,则用熔融氯化铝作电解液 | |
| C. | 若为工业制钠的装置,则钠在a上生成 | |
| D. | 若利用该装置回收氯化铜溶液中的铜,则a不能是铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com