
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| a |
| 4 |
| 5 |
| 4 |
| 5 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

| 0.082 |
| 0.06×0.182 |
| 0.082 |
| 0.06×0.182 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:填空题
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是??????? 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)? ΔH>0
CO(g) + 3H2(g)? ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定??
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定??????
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:简答题
天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2 中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 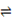 CO(g)
+ 3H2(g) ΔH = +206.2 kJ/mol
CO(g)
+ 3H2(g) ΔH = +206.2 kJ/mol
CH4(g) + 2H2O(g) 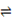 CO2(g)
+4H2(g) ΔH = +165.0kJ/mol
CO2(g)
+4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
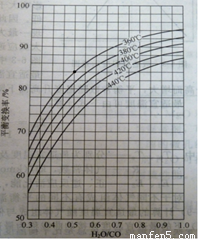
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是 。
② 汽气比相同时,CO平衡变换率与温度的关系是 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp= 。随温度的降低,该平衡常数 (填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
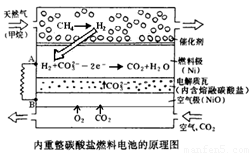
(1)外电路电子流动方向:由 流向 (填字母)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e‑ 转移,有 g 精铜析出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com