
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |
分析 A.硫酸氢钠在熔融状态下完全电离生成钠离子和硫酸氢根离子;
B.醋酸中加水,醋酸的电离程度增大,溶液中氢离子的物质的量增大、醋酸的物质的量减小,根据在同一溶液中判断该比值的变化;
C.升高温度后一水合氨的电离程度增大;
D.加入氢氧化钠溶液后,氯气的量减少,则次氯酸的浓度减小.
解答 解:A.硫酸氢钠为强电解质,在熔融状态下完全电离生成钠离子和硫酸氢根离子,正确的电离方程式为:NaHSO4=Na++HSO4-,故A错误;
B.在0.1m0L,L-1醋酸中加水,醋酸的电离程度增大,溶液中氢离子的物质的量增大、醋酸的物质的量减小,由于在同一溶液中,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,故B正确;
C.弱电解质的电离为吸热反应,则升温可使电离平衡NH3•H2O?NH4++OH-向右移动,故C错误;
D.向氯水中加人少量氢氧化钠溶液,导致氯气的量减少,溶液中次氯酸的物质的量减少,则溶液中c(HClO)减小,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响弱电解质电离平衡的因素为解答关键,注意A中熔融硫酸氢钠电离出的是HSO4-,为易错点.


科目:高中化学 来源: 题型:选择题
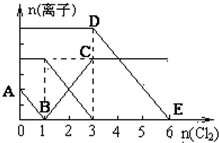 已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-═2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2═2Fe3++I2+4Cl━ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl与KOH+CH3COOH | B. | NaOH+H2SO4与 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4与Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 与Na2CO3+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4:3 | B. | 7:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:实验题
用中和滴定法测定烧碱的纯度,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转酸式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度为: ,样品烧碱的质量分数为________________。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(6)滴定过程(酚酞作指示剂),下列情况会使测定结果偏高的是 。
①酸式滴定管用水洗后便装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录起始体 积时,仰视读数,终点时俯视。
积时,仰视读数,终点时俯视。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸
④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com