
| A. | ①②④ | B. | ②③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:①单位时间内生成a mol O2的同时生成2a mol NO2,生成amol氧气,会消耗2amol二氧化氮,说明了正逆反应速率相等,达到了平衡状态,故①正确;
②混合气体的平均相对分子质量不再改变的状态,反应方程式两边完全的物质的量不同,气体的质量固定,所以平均相对分子质量不再改变,说明达到了平衡状态,故②正确;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态,各组分的浓度大小关系,不能说明各组分的浓度是否变化,正逆反应速率是否相等,故③错误;
④混合气体的颜色不再改变,说明二氧化氮的浓度不再变化,达到了平衡状态,故④正确;
⑤混合气体的密度不再改变的状态,由于反应两边都是气体,容器的体积不变,所以反应中密度始终不变,即密度不能作为判断化学平衡的依据,故⑤错误;
所以正确的有①②④,
故选A.
点评 本题考查化学平衡状态的判断,注意分析时要从化学方程式的反应特征判断,平衡状态的本质时正逆反应速率相等.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | 氢化物的稳定性为H2E<H2D | |
| C. | B与E形成的化合物既能溶于盐酸又可溶于氢氧化钠溶液 | |
| D. | 最高价氧化物对应水化物碱性:B比A的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1,△H2都不变 | B. | △H1,△H2都增大 | C. | △H1,△H2都减小 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
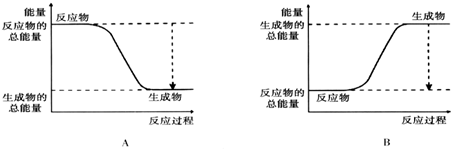
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、丙三醇都是无色溶于水的有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| B. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| C. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| D. | 常温下,4gCH4含有NA 个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
 ;
;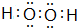 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com