
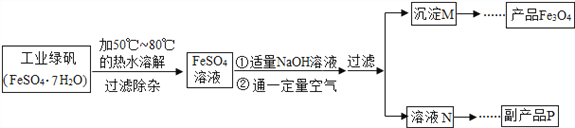
【题目】某化学兴趣小组对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图:
 【查阅资料】
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2 +2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2 + 2Fe(OH)3 ![]() Fe3O4+4H2O
Fe3O4+4H2O
Ⅰ【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是__________________________________________。
(2)副产品P是___________________________。
(3)为了得到纯净的产品,过滤、洗涤后进行的具体操作过程为______________________________、干燥
Ⅱ【组成确定】
资料显示:①铁的氢氧化物在受热时分解生成铁的氧化物(化合物不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的四氧化三铁的纯度,同学们称取了23.28g该Fe3O4样品设计下列实验进行探究。
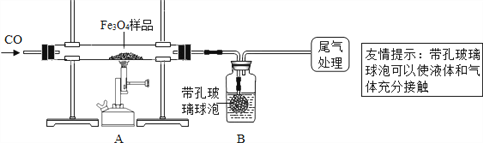
(1)该组同学欲通过称量B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质。B中的最佳试剂是_______________________(填序号)。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,以及B中的溶液倒吸入A中;且可以_____________________________,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中
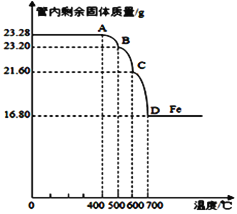
①该Fe3O4样品中含有的杂质成分______________________(填化学式)
②计算样品中Fe3O4的质量分数(写出必要的计算过程)。 _____________
【答案】 该温度时硫酸亚铁的溶解度较大 Na2SO4 取最后一次洗涤的滤液于试管中,加入(盐酸酸化的)BaCl2溶液,若无白色沉淀,说明已经洗涤干净 B 将产生的CO2全部赶入装置B中 Fe2O3 设Fe2O3和Fe3O4的物质的量分别为x、y,根据铁原子守恒有2x+3y=16.80/56mol =0.3mol ,根据质量有:160x+232y=23.28,所以解得y=0.09mol,故样品中Fe3O4的质量分数=0.09×232g÷23.28g×100%=89.69%。
【解析】Ⅰ(1)根据FeSO4的溶解度表可知,50℃至80℃时FeSO4的溶解度较大,其他温度下溶解度较小,不利于溶解,故答案为:该温度时硫酸亚铁的溶解度较大。
(2)FeSO4与NaOH反应除了生成Fe(OH )2,还生成Na2SO4,故副产物P为Na2SO4。
(3)沉淀的成分为Fe(OH)2和Fe(OH)3,其中含有杂质Na2SO4,要得到纯净的产品,必须将沉淀洗涤干净,因此过滤、洗涤后进行的操作过程为:取最后一次洗涤的滤液于试管中,加入盐酸酸化的BaCl2溶液,若无白色沉淀,说明已经洗涤干净。
Ⅱ(1)CO和Fe3O4反应生成CO2气体,吸收CO2气体的最好的试剂为NaOH溶液,故B中的最佳试剂为NaOH,答案为B。
(2)CO还可以将产生的CO2气体全部赶入装置B中,提高实验的准确率,故答案为:将产生的CO2全部赶入装置B中。
(3)①若样品中只有Fe3O4,加热过程中固体质量下降应只有两段,而现在样品的质量下降有三段,故样品中除了Fe3O4外还有其他成分,沉淀M为Fe(OH)2和 Fe(OH)3的混合物,加热时除生成Fe3O4外,Fe(OH)3加热分解能生成Fe2O3,故Fe3O4样品中含有的杂质成分为Fe2O3。 ②设Fe2O3和Fe3O4的物质的量分别为x、y,根据铁原子守恒有2x+3y=(16.80/56)mol =0.3mol ,根据质量有:160x+232y=23.28,所以解得y=0.09mol,故样品中Fe3O4的质量分数=0.09×232g÷23.28g×100%=89.69%。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
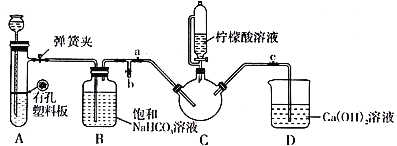
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题:
Ⅰ.丁腈橡胶(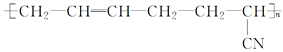 )具有优良的耐油、耐高温性能,合成丁腈橡胶的二种单体是_________________和_______________,是通过___________反应得到。
)具有优良的耐油、耐高温性能,合成丁腈橡胶的二种单体是_________________和_______________,是通过___________反应得到。
Ⅱ. 硅橡胶具有无毒,无味,耐高温又耐低温,可制成耐温垫圈,密封件和人造心脏,人造血管等,他是由单体二甲基二氯硅烷(CH3)2SiCl2水解得到二甲基硅二醇,经脱水缩聚成的聚硅氧烷再经交联制成的,请用化学方程式写出上述二甲基二氯硅烷水解及线性缩聚的方程式_________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同分异构现象在有机化合物中是非常普遍的。下列各组化合物:
①CH3CH2CH2CH3和(CH3)2CHCH3; ②CH3CH2OH和CH3CH2CH2OH;
③CH3COOCH2CH3和CH3CH2CH2COOH; ④CH3CH=CHCH3和CH3CH2CH=CH2;
⑤![]() 和
和![]() 。其中互为同分异构体的是______________________(填序号)。
。其中互为同分异构体的是______________________(填序号)。
(2)下列5种有机化合物:乙酸乙酯(CH3COOCH2CH3)、苯酚(![]() )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH)。
①其中能与Na2CO3溶液反应产生气泡的是______________________。
②其中能与FeCl3溶液发生显色反应的是________________________。
③其中能发生银镜反应的是________________________。
④写出乙酸乙酯碱性条件水解反应的化学方程式____________________________。
(3)①蛋白质是维持生命的重要物质,它是由_____________________通过缩聚反应生成的一类高分子化合物;氨基酸因分子中含有的官能团是____________________和____________________,而具有__________________性。
②2008年,三鹿婴幼儿奶粉由于人为添加三聚氰胺,导致长期食用该奶粉的部分婴幼儿出现肾结石病。三聚氰胺的结构简式如下图所示。
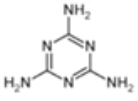
请你预测三聚氰胺在核磁共振氢谱图(1H核磁共振谱图)中会出现____________________个峰;三聚氰 胺中氮元素的质量分数为______________________(结果用百分数表示,并保留一位小数),添加三聚氰胺会使食品中蛋白质的含量虚高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是()
A. 加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B. 将该溶液加水稀释,![]() 的比值保持不变
的比值保持不变
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
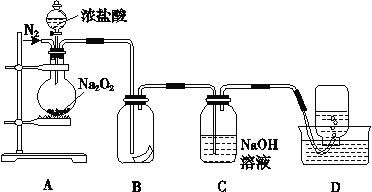
实验步骤及现象如下:
①检查装置气密性后,装入药品Na2O2并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸
入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有______(填化学式)生成。若将B中红纸条改为湿润的紫石蕊试纸,现象为 _______
(2)实验前通N2的目的 ____,装置C的作用是_______
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,其不赞成的理由可能为: ①_______;②O2有可能是Na2O2与盐酸中的H2O反应所得.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com