
��15�֣����ƣ�������������Դ�������Ⱦ�Ǹ��ƴ�����������Ҫ������
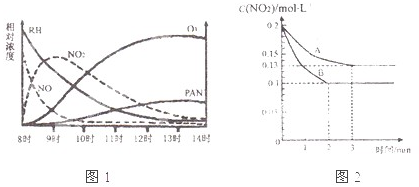
��1��ij�о���ѧϰС����һ����ʵ�����жԹ⻯ѧ�����γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪC2H8��������NO2��O3��PAN��CH3COOONO2���������ʵ����Ũ����ʱ��ı仯����¼����ͼ������ͼ�����ݣ����������к������� ����д��ţ�
A��NO�����ĵ����ʱ�CxHy��
B��C2H8 ��NO2��
��NO2�� Ӧ��������PAN��O2
Ӧ��������PAN��O2
C��CxHy��O3��Ӧ����PAN
��2���������糧��ȼú�����к������ĵ������NO ���������ü����NO
���������ü����NO ��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ
��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ ����ʽΪ ��
����ʽΪ ��
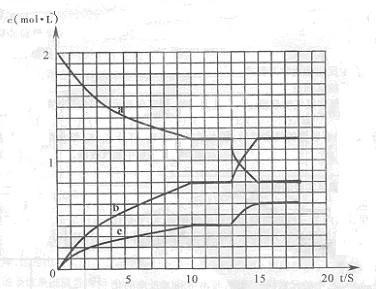
��3����һ�ܱ������з�����Ӧ2NO2 2NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��
2NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��
��ش�
��ͼ�б�ʾNO2�ı仯�������� ����O2��ʾ��O��10s�ڸ÷�Ӧ��ƽ������v(O2)= ��
����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a.v(NO2)=2v(O2) b.������ѹǿ���ֲ���
c.v��(NO)=2v��(O2) d.�������ܶȱ��ֲ���
�۵�13����ʱ���ı�ʵ���������¶ȡ�ѹǿ���������õ��¶���ʱ��仯�����ߣ����13���Ӹı�������� ��
��4��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
����2N2O5��g�� 4NO2(g)+O2(g)
4NO2(g)+O2(g)
����2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
���ﵽƽ��ʱ��c(NO2) =0.4mol��L-1��c(O2)=1.3mol��L-1����Ӧ����NO2��ת����Ϊ ��N2O5(g)����ʼŨ��Ӧ������ mol��L-1��
 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| C4(NO2)C(O2) |
| C2(N2O5) |
| C4(NO2)C(O2) |
| C2(N2O5) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��15�֣����ƣ�������������Դ�������Ⱦ�Ǹ��ƴ�����������Ҫ������
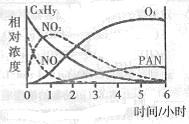
��1��ij�о���ѧϰС����һ����ʵ�����жԹ⻯ѧ�����γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪC2H8��������NO2��O3��PAN��CH3COOONO2���������ʵ����Ũ����ʱ��ı仯����¼����ͼ������ͼ�����ݣ����������к������� ����д��ţ�
A��NO�����ĵ����ʱ�CxHy��
B��C2H8��NO2��Ӧ��������PAN��O2
C��CxHy��O3��Ӧ����PAN
��2���������糧��ȼú�����к������ĵ������NO![]() ���������ü����NO
���������ü����NO![]() ��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ����ʽΪ ��
��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ����ʽΪ ��
��3����һ�ܱ������з�����Ӧ2NO22NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��
��ش�
��ͼ�б�ʾNO2�ı仯�������� ����O2��ʾ��O��10s�ڸ÷�Ӧ��ƽ������v(O2)= ��
����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a.v(NO2)=2v(O2) b.������ѹǿ���ֲ���
c.v��(NO)=2v��(O2) d.�������ܶȱ��ֲ���
�۵�13����ʱ���ı�ʵ���������¶ȡ�ѹǿ���������õ��¶���ʱ��仯�����ߣ����13���Ӹı�������� ��
��4��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
����2N2O5��g��4NO2(g)+O2(g)
����2NO2(g) 2NO(g)+O2(g)
���ﵽƽ��ʱ��c(NO2)=0.4mol��L-1��c(O2)=1.3mol��L-1����Ӧ����NO2��ת����Ϊ ��N2O5(g)����ʼŨ��Ӧ������ mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ�Ž��и����ڶ���ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
��15�֣����ƣ�������������Դ�������Ⱦ�Ǹ��ƴ�����������Ҫ������
��1��ij�о���ѧϰС����һ����ʵ�����жԹ⻯ѧ�����γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪC2H8��������NO2��O3��PAN��CH3COOONO2���������ʵ����Ũ����ʱ��ı仯����¼����ͼ������ͼ�����ݣ����������к������� ����д��ţ�
A��NO�����ĵ����ʱ�CxHy��
B��C2H8��NO2��Ӧ��������PAN��O2
C��CxHy��O3��Ӧ����PAN
��2���������糧��ȼú�����к������ĵ������NO ���������ü����NO
���������ü����NO ��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ����ʽΪ
��
��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ����ʽΪ
��
��3����һ�ܱ������з�����Ӧ2NO2 2NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��
2NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��

��ش�
��ͼ�б�ʾNO2�ı仯�������� ����O2��ʾ��O��10s�ڸ÷�Ӧ��ƽ������v(O2)= ��
����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a.v(NO2)=2v(O2) b.������ѹǿ���ֲ���
c.v��(NO)=2v��(O2) d.�������ܶȱ��ֲ���
�۵�13����ʱ���ı�ʵ���������¶ȡ�ѹǿ���������õ��¶���ʱ��仯�����ߣ����13���Ӹı�������� ��
��4��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
����2N2O5��g�� 4NO2(g)+O2(g)
4NO2(g)+O2(g)
����2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
���ﵽƽ��ʱ��c(NO2) =0.4mol��L-1��c(O2)=1.3mol��L-1����Ӧ����NO2��ת����Ϊ ��N2O5(g)����ʼŨ��Ӧ������ mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ƣ�������������Դ�������Ⱦ�Ǹ��ƴ�����������Ҫ������
��1��ij�о���ѧϰС����һ����ʵ�����жԹ⻯ѧ�����γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪC2H8��������NO2��O3��PAN��CH3COOONO2���������ʵ����Ũ����ʱ��ı仯����¼����ͼ������ͼ�����ݣ����������к������� ����д��ţ�

A��NO�����ĵ����ʱ�CxHy��
B��C2H8��NO2��Ӧ��������PAN��O2
C��CxHy��O3��Ӧ����PAN
��2���������糧��ȼú�����к������ĵ������NO![]() ���������ü����NO
���������ü����NO![]() ��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ����ʽΪ ��
��һ�������·�Ӧ��������Ⱦ����CH4��NO2��Ӧ�Ļ�ѧ����ʽΪ ��
��3����һ�ܱ������з�����Ӧ2NO2![]() 2NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��
2NO+O3����H>0����Ӧ������Ũ����ʱ��仯���������ͼ��ʾ��
��ش�
��ͼ�б�ʾNO2�ı仯�������� ����O2��ʾ��O��10s�ڸ÷�Ӧ��ƽ������v(O2)= ��
����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a.v(NO2)=2v(O2) b.������ѹǿ���ֲ���
c.v��(NO)=2v��(O2) d.�������ܶȱ��ֲ���
�۵�13����ʱ���ı�ʵ���������¶ȡ�ѹǿ���������õ��¶���ʱ��仯�����ߣ����13���Ӹı�������� ��
��4��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
����2N2O5��g��![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
����2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
���ﵽƽ��ʱ��c(NO2) =0.4mol��L-1��c(O2)=1.3mol��L-1����Ӧ����NO2��ת����Ϊ ��N2O5(g)����ʼŨ��Ӧ������ mol��L-1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com