
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

| 探究温度、压强对化学反应速率的影响;测定某些化学反应的速率;化学实验方案的评价. | |
| 专题: | 化学反应速率专题. |
| 分析: | (1)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大; (2)先求出反应的(MnO4﹣)的物质的量,再求出反应后的浓度; (3)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率; (4)催化剂能加快化学反应的速率. |
| 解答: | 解:(1)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,故答案为:浓度;②;①; (2)CO2的物质的量是:4.48mL×10﹣322.4mol/l=0.0002mol,设2min末,反应(MnO4﹣)为X 2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 2 10 X 0.0002mol 解得 X=0.00004mol 30mL×10﹣3×0.01mol•L﹣1﹣0.00004mol=0.00026mol C(MnO4﹣)=nv=0.00026mol0.05L=0.0052mol/L 故答案为:0.0052; (3)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,故答案为:KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间; (4)催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,故答案为:产物Mn2+(或MnSO4)是反应的催化剂. |
| 点评: | 本题考查了影响化学反应速率的因素,难度不大,注意可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率. |


科目:高中化学 来源: 题型:
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
|
| A. | 容量瓶事先未烘干 |
|
| B. | 定容时俯视观察液面 |
|
| C. | 未用蒸馏水洗涤烧杯 |
|
| D. | 定容后,摇匀时有少量液体流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.(已知﹣OH,﹣COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题:
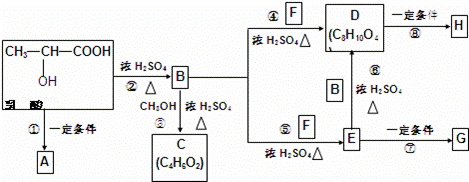
(1)推断结构简式,C: ;F: .
(2)B中所含的官能团有 ;反应③的反应类型是 .
(3)反应①的化学方程式为 .
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性.一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4( g )+4NO2( g )═4NO( g )+CO2( g )+2H2O( g )△H=﹣574kJ•mol﹣1
②CH4( g )+4NO( g )═2N2( g )+CO2( g )+2H2O( g )△H=﹣1160kJ•mol﹣1.
下列正确的选项是( )
|
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=﹣867kJ•mol﹣1 |
|
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2mol |
|
| C. | 若0.2mol CH4还原NO2至N2,在上述条件下放出的热量为173.4kJ |
|
| D. | 若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
|
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 |
|
| B. | 由C(石墨)→C(金刚石)△H=+119kJ•mol﹣1可知,金刚石比石墨稳定 |
|
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 |
|
| D. | 在稀溶液中,H+(aq)+OH﹣(aq)═(H2O)(l)△H=﹣57.3kJ•mol﹣1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
分析如图所示的四个原电池装置,结论正确的是( )
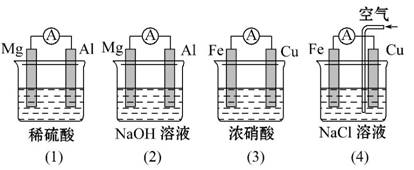
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-====6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-====Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-====H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr
Na2S4+3NaBr
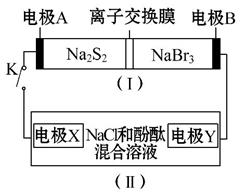
当闭合K时,X极附近溶液先变红色。下列说法中正确的是 ( )
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为NaBr3+2Na++2e-====3NaBr
C.X电极的电极反应式为2Cl--2e-====Cl2↑
D.每有0.1 mol Na+通过离子交换膜,X电极上就放出标准状况下的气体1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH一═H2O |
|
| B. | 铝与稀盐酸反应:Al+2H+═Al3++H2↑ |
|
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH一═Fe(OH)3↓+3Cl﹣ |
|
| D. | 二氧化碳与石灰水反应:CO2+2OH一═CO32一+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是_____________________________________
___________________________________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:____________
_____________________________________;
(4)该反应达到平衡时反应物X的转化率α等于______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com