
| A. | 冰融化成水放出热量 | |
| B. | 化学键断裂过程一定放出能量 | |
| C. | 生成物的总能量一定低于反应物的总能量 | |
| D. | 化学键的断裂和形成是化学反应中能量变化的主要原因 |
分析 化学的实质为旧化学键的断裂和新化学键的形成,断裂化学键吸收能量,形成化学键放出能量,如反应物总能量大于生成物总能量,为放热反应,反之为吸热反应,以此解答该题.
解答 解:A.由固体变为液体,为吸热过程,故A错误;
B.化学键断裂过程一定吸收能量,故B错误;
C.如为放热反应,则生成物的总能量一定低于反应物的总能量,反之为吸热反应,故C错误;
D.化学的实质为旧化学键的断裂和新化学键的形成,断裂化学键吸收能量,形成化学键放出能量,则化学反应一定伴随着能量变化,故D正确.
故选D.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力以及基本理论知识的理解和运用,注意相关概念的理解,难度不大.


科目:高中化学 来源: 题型:选择题
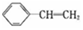 .有关该物质的下列说法正确的是( )
.有关该物质的下列说法正确的是( )| A. | 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物有6种 | |
| B. | 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同 | |
| C. | 苯乙烯分子的所有原子不可能在同一平面上 | |
| D. | 除去 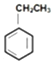 中的苯乙烯可以通入等量氢气反应 中的苯乙烯可以通入等量氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯是非常重要的有机溶剂和化工原料,如图转化关系中的①、②、③是工业上合成乙酸乙酯的常见反应,其中A是一种常见的调味品.请回答:
乙酸乙酯是非常重要的有机溶剂和化工原料,如图转化关系中的①、②、③是工业上合成乙酸乙酯的常见反应,其中A是一种常见的调味品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-、Cl- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和O2 | |
| B. | 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1molCl2,转移电子2mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
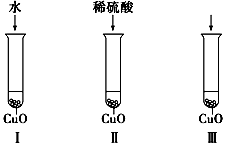 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
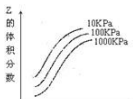
| A. | 上述可逆反应的正反应为放热反应 | |
| B. | X、Y、Z 均为气态 | |
| C. | X 和 Y 中只有一种是气态,Z 为气态 | |
| D. | 上述反应的正反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HNO3>H3BO3>H2CO3 | B. | 稳定性:HF>PH3>H2O | ||
| C. | 碱性:Be(OH)2>Mg(OH)2>Ca(OH)2 | D. | 金属性:K>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com