
下列有关化学概念或原理的论述中,正确的是
A.任何一个氧化还原反应都可以设计为电池,输出电能
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.电解饱和食盐水的过程中,水的电离平衡正向移动
D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源:2013-2014吉林松原市高二下学期期末化学试卷(解析版) 题型:选择题
基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为
A.p区、第五周期、ⅠB族 B.ds区、第五周期、ⅠB族
C.d区、第四周期、ⅠB族 D.ds区、第五周期、Ⅷ族
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林市高一化学下学期期末教学质量检测试卷(解析版) 题型:填空题
(6分)将检验下列溶液所用试剂的序号填入相应的括号中。
①检验葡萄糖溶液( );②检验淀粉溶液( );③检验蛋白质溶液( )。
A KI溶液 B碘水 C浓硝酸 D.稀硫酸 E.新制的Cu(OH) 2悬浊液
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林市高一化学下学期期末教学质量检测试卷(解析版) 题型:选择题
下列关系中,正确的是
A.原子半径:Mg>K B.非金属性:O<S
C.稳定性:HCl>HBr D.碱性:NaOH>KOH
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市通州区高考二模理综化学试卷(解析版) 题型:填空题
(14分)下表为元素周期表的一部分:
周期 |
|
|
| |||||
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
|
|
| ② |
|
|
3 | ③ |
|
| ④ |
| ⑤ | ⑥ |
|
Ⅰ.用化学用语回答下列问题:
(1)写出元素④在周期表中的位置: ;
(2)②③⑤的原子半径由大到小的顺序为 ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化
合物的电子式: 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:
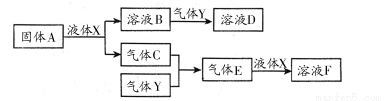
(1)写出固体A与液体X反应的离子方程式: ;
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
A.40.32 LB.30.24 LC.20.16 LD.13.44 L
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区高三二模理综化学试卷(解析版) 题型:实验题
(13分)
利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。
流程如下:
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O72-(橙红色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
(1)步骤Ⅰ中红褐色沉淀的化学式是 。
(2)步骤Ⅱ中加入Na2SO3的目的是 。
(3)步骤Ⅳ中反应的离子方程式是 。
(4)步骤Ⅴ中加入的物质A可以是 。(填序号)
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL
0.50 mol/L的FeSO4溶液,恰好使Cr2O72-完全转化为Cr3+。产品中K2Cr2O7的纯度是 。(注:K2Cr2O7的摩尔质量为294 g/mol)
(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是 ,溶液pH变小的原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区高三二模理综化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.将地下钢管与直流电源的正极相连,用来保护钢管
C.电解饱和食盐水制氢氧化钠,可以用铁做阴极
D.氢氧燃料电池中,氢气在负极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com