
【题目】脍炙人口的“千锤万凿出深山,烈火焚烧若等闲;粉身碎骨浑不怕,要留清白在人间。”是明代名臣于谦的名作《石灰吟》。这四句中没有涉及化学变化的是
A.千锤万凿出深山 B.烈火焚烧若等闲
C.粉身碎骨浑不怕 D.要留清白在人间
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2)通常用作分析试剂、氧化剂、漂白剂等。制备反应原理为:Sr+O2![]() SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。
SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。

(1)选择必要仪器组装制备过氧化锶(气流按从左到右的流向):____________(填字母)。
(2)该实验制备氧气的化学方程式为______________。
(3)连接好装置并进行实验,实验步骤如下,实验操作顺序为___________(填字母)。
①打开分液漏斗活塞,将水滴入烧瓶②在相应装置中装入药品③检查装置气密性④加热
⑤停止加热⑥关闭分液漏斗活塞
(4)利用反应Sr2++H2O2+2NH3+8H2O=SrO2·8H2O↓+2NH4+,制备过氧化锶的装置如下:
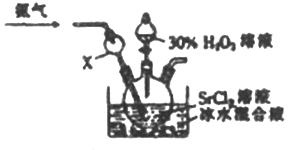
①X仪器的作用是_____________。
②氨气在该反应所起的作用是__________________。
③实验结束后,得到SrO2·8H2O的操作为_________________。
(5)设计实验证明SrO2的氧化性比FeCl3的氧化性强__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:
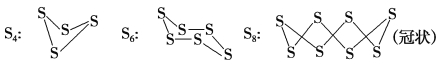
(1) 若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e,S(s)+O2(g)===SO2(g) ΔH=-a kJ·mol -1,则S8分子硫硫键的键能为 kJ·mol-1
(2)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2分子的体积分数不小于 (用百分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)①按系统命名法,化合物![]() 的名称是______________。
的名称是______________。
②二乙酸乙二酯的结构简式:_____________________。
(2)苯的同系物A,分子中共含66个电子,A苯环上一溴代物只有一种,A的结构简式为______________。
(3)C5H4理论上同分异构体的数目可能有30多种,如:
A.CH2=C=C=C=CH2 B.CH≡C-CH=C=CH2 C.![]() D.
D.![]() ,
,
其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式: 。
(4)![]() 分子中最多有 个原子共面。
分子中最多有 个原子共面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH﹣△H>0,下列叙述正确的是( )
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)醋酸钠的碱性 碳酸氢钠的碱性(大于、等于、小于)
(2)氯化铝水溶液呈酸的原因是(用离子方程式表示):____________ _____
(3)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
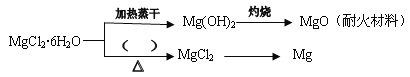
请回答下列问题:
(4)在上图的括号内应填的是在_______________环境中加热。
(5)Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)![]() Mg2++2OH-。向体系中加入(请填出两种不同类别的物质) 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质) 有利于Mg(OH)2溶解。
(6)MgCl2中混有了FeCl3杂质,可加入的除杂试剂( )
A MgO B Mg(OH)2 C NaOH D 铁屑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴周期表第四周期第Ⅷ族元素,其化合物用途广泛,如:LiCoO2做锂电池的正极材料;草酸钴可用于指示剂和催化剂制备。
Ⅰ.(1)LiCoO2中钴元素的化合价为_______
(2)工业上将废锂电池的正极材料与过氧化氢溶液,稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为:______________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是____________
Ⅱ.利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
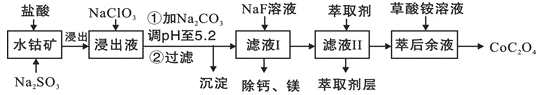
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(3)浸出液中加NaClO3的目的是:______________.
(4)请用平衡移动原理说明加Na2CO3调pH至5.2所得沉淀的原因:____________
(5)滤液Ⅱ中加入萃取剂的作用是___________
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A.乙烯在空气中燃烧
B.苯在一定条件下跟H2反应
C.苯在浓硫酸催化下与浓硝酸反应
D.乙烯在一定条件下跟HCl反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com