
��09�γǵ����ε��У�һЩ�ϻ��õĽ�����ijЩ�ض��Ľ��ʻ����У����Ϊ����״̬���������ڽ��������ϸ�����һ������Ĥ�����ڲ�ͬŨ�ȵ��������ܽ���ۻ������ͼ��ʾ����̽���������⣺
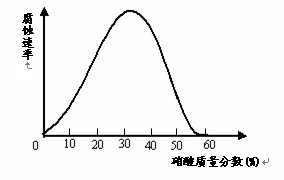
��1������һö��������������ʹ������γɶۻ��㣬Ӧ�������Ũ�ȴ��� ��������һ��ʱ�䣻֤����������γ�һ�����ܵĶۻ���ļ�ʵ���ǣ� �������������� ��
��2�������й�˵������ȷ���� ��ѡ����ţ���
![]()
A��ͭ���������Ũ���ᣬ����Ϊͭ��Ũ�����з����ۻ�
B��ͭƬ����Ƭ�õ������Ӻ�������Ũ�����У�����һ��������ͭ�缫�ص�����������
C������������Һ�еĸ�ʴ����������Ũ��һ��������
D���������Ũ�����ȥ���������ڵ�ˮ��
��3������Һ����NaNO3��NaNO2��NaOH��ɵģ��ڼ��������£�ͨ��������Ӧʹ����������һ�����ܵ�Fe3O4��3Fe+NaNO2+5NaOH![]() 3Na2FeO2+H2O+NH3�����������٣�
3Na2FeO2+H2O+NH3�����������٣�
8Fe+3NaNO3+5NaOH+2H2O![]() 4Na2Fe2O4+3NH3�������ڣ�
4Na2Fe2O4+3NH3�������ڣ�
�Լ������������������������벹���������Ӧ�ķ���ʽ����ƽ�� ��
��4��Ϊ��ʹ�������γɽϺ������Ĥ����ҵ�ϳ��õ��������Һ�ķ�������������������������д����ʱ�����ĵ缫��Ӧ�� ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(09�γǵ����ε���)CaO2?8H2O�ʰ�ɫ������ˮ��������350�����ҿ�ʼ�ֽ�ų�������425��ֽ���ȫ���������ƿ������ڸ��Ƶر�ˮ�ʡ��������ؽ������ӷ�ˮ�������ೱ��Ҳ������Ӧ�������ȡ�ʵ�������ô���ʯ����MgCO3��FeCO3�����ʣ���ȡ������̼��ƣ�Ȼ�����ô���̼�����ȡ�������ơ�ʵ���������£���֪��Ca(OH)2+H2O2+6H2O��CaO2?8H2O ��H��0����
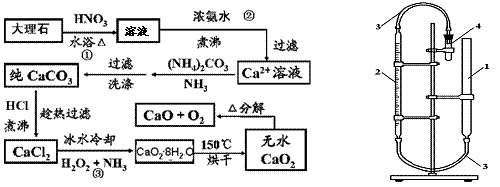
��1��д��CaO2�ĵ���ʽ�� �������� ��
��2��ͼʾ����ڣ�����Ũ��ˮ�������Ե�Ŀ���ǣ� �� �� ��
��3������۷�����Ӧ�Ļ�ѧ����ʽΪ�� �� �� ��
��4��������ñ�ˮ��ȴ�Ŀ���ԭ���ǣ� ���� ��
��5��������ͼ���������ɲⶨ��Ʒ��CaO2�������������ȼ��װ�õ������ԣ�Ȼ������������ע��һ������ˮ��������4���Թ���ע��9.0g��Ʒ�����Ӻ�װ�ã���ּ�����4��ʾ��С�Թܡ����ڱ�״�����ռ���840mL���壬��CaO2����Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]()
��1��ʵ���Ҽ���XCl��YCl�ij��÷����ǣ�
![]()
��2����Ӧ�ڵĻ�ѧ����ʽΪ��
![]()
��3��������ӦӦ���ڹ�ҵ����ʱ������ֱ��ѭ��ʹ�õ������ǣ�
![]()
��4��X2C2��ˮ��Ӧ������һ���л�С���ӣ����л�С���ӵĽṹʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��09�γǵ����ε��У��Ȼ����dz�����ˮ����������ˮFeCl3���۵�Ϊ555K���е�Ϊ588K����ҵ���Ʊ���ˮFeCl3��һ�ֹ������£�
��1��ȡ0.5mL���Ȼ�����Һ����50mL��ˮ�У������Ƭ�̵ú��ɫ��Һ�壬�ù��̿������ӷ���ʽ��ʾΪ�� ��
��2����֪��ˮ���Ȼ�����ˮ�е��ܽ�����£�
�¶�/��. | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
�ܽ��(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
��FeCl3��Һ�л��FeCl3?6H2O�ķ����ǣ� ��
��3�����������¶ȳ���673K��������Է�������Ϊ325�����ʣ������ʵķ���ʽΪ�� ��
��4������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpHΪ2.7ʱ��Fe3+��ʼ����������ҺpHΪ4ʱ��c(Fe3+)= mol/L����֪��Ksp[Fe(OH)3]= 1.1��10��36����
��5�����ռ�X��: �������������ռ�X�������ǣ� ��
��6��FeCl3����������ͨ�����õ������ⶨ����ȡmg��ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100mL����ƿ��������ˮ���ݣ�ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���õ�����ָʾ������cmol/LNa2S2O3��Һ�ζ���I2+2S2O32��=2I�� +S4O62����������ȥVmL������Ʒ���Ȼ�������������Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
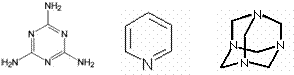
��09�γǵ����ε��У�����X��Y��Z�����л���(����Է���������С��100)�����Ǻ�̼���⡢������4��Ԫ���е����ֻ����֡���һ����ѧϰС���ͬѧ��ȷ�����ǵ���ɻ�ṹ��
��1���ⶨ�л�����Է����������õķ���ͨ���� ������ţ���ͬ���ٺ�����ף������ף�����˴Ź����ף���
Ԫ�ط��������������ʵ���˴Ź�����ֻ��һ�����շ���ǣ�
![]()
![]()
![]()
![]()
![]()
![]() ���� �����飬 �� �� �� �� �� ��
���� �����飬 �� �� �� �� �� ��
![]()
![]() ��2��X��C��H��O��N����Ԫ����ɣ���(N)=18.67%����X���������ᷴӦ����������������Һ��Ӧ����X���ܵĽṹ��ʽΪ�� ��
��2��X��C��H��O��N����Ԫ����ɣ���(N)=18.67%����X���������ᷴӦ����������������Һ��Ӧ����X���ܵĽṹ��ʽΪ�� ��
��3��Y��Z����Է���������ȣ�������ȫȼ��ʱ��ֻ������CO2��H2O��N2�е����ֻ����֡�ijͬѧȡһ������Y��Z�Ļ�����ȫȼ��ʱ�ڱ�״���µ�ʵ�������£�
ʵ����� | ����� ���� | ���ʵ�����ϵn(Y)/n(Z) | ������� | ||
m(CO2)/g | m(H2O)/g | V(N2)/mL | |||
�� | 3g | 2��3 | 3.08 | 1.8 | 672 |
�� | 3g | 3��2 | 3.52 | 1.8 | 448 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��09�γǵ����ε��У�����ˮ���ᣨdiflunisal����һ�����͵�ˮ��������������ʹ��ҩ������ǿЧ����Ч�Ͷ����ص㡣һ�ֿ��еĺϳ�·������(�������ܼ�����ʡȥ)��

�Իش��������⣺
��1���йط���ˮ���������˵����ȷ���� ��ѡ����ţ�
A��������ֻ�����ֹ�����
B������������ԭ�ӿ��Դ���ͬһƽ��
C��1mol����ˮ������������̼��������Һ��Ӧ��������2molCO2
D����һ��pH�����£�����ˮ������FeCl3��Һ�ܷ�����ɫ��Ӧ
��2��ͼ���л��A��Ϊ2��4���������������ж���ͬ���칹�壬���к��б����ṹ���칹�壨������������ �֡�
��3��������Ӧ������ȡ����Ӧ���У� ��ѡ����ţ��٢ڢۢܣ���
��4����Ӧ�ڵķ���ʽΪ�� ��
��5�����������ϳɷ���ˮ�����ԭ�������Ա���Ϊԭ���ϳ�����ˮ���ᣨ 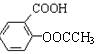 ��
��
���÷�Ӧ����ͼ��ʾ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com