
| A. | Cs2CO3比CsHCO3稳定 | |
| B. | CsOH是一种强碱 | |
| C. | 可能存在Cs2O2 | |
| D. | Cs在金属活动性顺序表中排在K后面 |
分析 A、根据碳酸钠比碳酸氢钠稳定判断;
B、碱金属元素按照周期表顺序从上到下碱性逐渐增强;
C、根据存在Na2O2分析;
D、碱金属元素按照周期表顺序从上到下金属性逐渐增强.
解答 解:A、因为碳酸钠比碳酸氢钠稳定,所以Cs2CO3比CsHCO3稳定,故A正确;
B、碱金属元素按照周期表顺序从上到下碱性逐渐增强,因为NaOH为强碱,所以氢氧化铯是强碱,故B正确;
C、因为存在Na2O2,所以可能存在Cs2O2,故C正确;
D、碱金属元素按照周期表顺序从上到下金属性逐渐增强,所以Cs在金属活动性顺序表中排在K前面,故D错误.
故选D.
点评 本题考查学生碱金属的性质的递变规律,注意知识的积累是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏原理适用于分离互不相溶的液体混合物 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 蒸馏操作时,冷凝管中冷却水应该是上口进下口出 | |
| D. | 蒸馏操作时,沸点高的物质先被蒸出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g甲基(-CH3)所含有的电子数是9NA | |
| B. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金只能由金属熔合而成 | |
| B. | 硬铝、黄铜、生铁均属于合金 | |
| C. | 焊锡(锡铅合金)熔点比金属锡低 | |
| D. | 合金的硬度可以大于它的纯金属成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
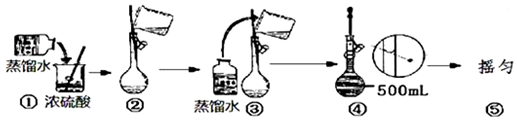
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| B | 0.1 | c(Na+)>c(AlO2-)>c(CO32-)>c(OH-)>c(H+) |
| C | 0.2 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D | 0.3 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 g 98%的硫酸(密度为1.84 g/cm3)与5 mL 18.4 mol/L硫酸的浓度是不同的 | |
| B. | 制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
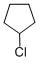 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$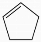 +NaCl+H2O.
+NaCl+H2O.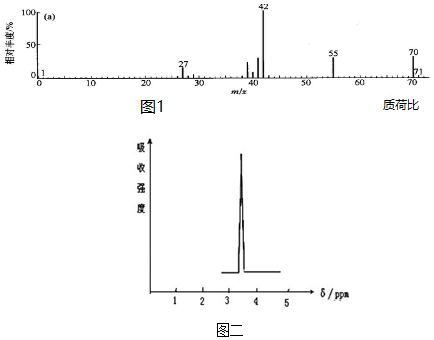
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com