
【题目】在一定条件下,某化合物X受热分解:2X = A ↑+2B↑ + 4C↑,测得反应后生成的混合气体对H2的相对密度为12.则在相同条件下,X的相对分子质量是( )
A. 36B. 42C. 72D. 84
科目:高中化学 来源: 题型:
【题目】写出下列反应的方程式
(1)1,3﹣丁二烯与溴发生1,4加成;
(2)苯酚钠溶液中通入少量CO2;
(3)乙醛与新制氢氧化铜浊液加;
(4)1,2﹣﹣二氯乙烷与氢氧化钠溶液加热;
(5)2﹣氯丙烷与NaOH的乙醇溶液共热 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)给定条件下的下列四种物质:①标准状况下112mL液态水,②含有40mol质子的NH3, ③2mol的乙醇,④4g氦气,则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)标准状况下,0.51g某气体的体积为672mL,则该气体相对分子质量为______。
(3)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
(4)标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL,则所得溶液溶质物质的量浓度=________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在水溶液中或熔化状态下能导电的物质称为电解质
B.强酸、强碱和大多数盐属于强电解质
C.自由移动离子数目多,导电能力一定强
D.碱性氧化物不一定是金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是______(用字母代号填).
A.FeB.FeCl3C.FeSO4D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm.
(3)检验溶液中Fe3+存在的试剂是______(填物质名称),证明Fe3+存在的现象是______.电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:______.
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是______.
(5)欲从制造印刷电路板的废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
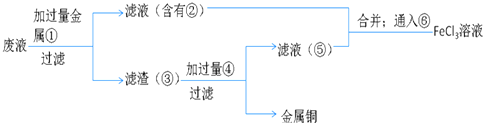
A.请写出上述实验中加入或生成的有关物质的化学式:
①______④______
B.请写出通入⑥反应的离子方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在浓硫酸中发生钝化,是因为金属在浓硫酸作用下在表面形成了致密的金属氧化物薄膜,在这个过程中,金属元素发生的变化是()
A. 被氧化 B. 发生还原反应 C. 做氧化剂 D. 金属氧化物薄膜是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使反应顺利进行,则可以从长颈漏斗中加入的试剂是 ( )
①食盐水②KNO3溶液③适量硫酸铜溶液④Na2CO3溶液⑤CCl4 ⑥浓氨水
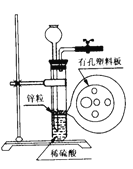
A. ①②④ B. ②⑥ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性NH4+< Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水不可以直接排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com