

分析 金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,A的焰色反应为黄色,则A是Na,钠和水反应生成氢氧化钠和氢气,则甲是H2、I是NaOH,氢氧化钠和金属单质B反应生成氢气,则B是Al,黄绿色气体乙是Cl2,丙为HCl,E是盐酸,I和G反应生成红褐色沉淀H,则H是Fe(OH)3、G中含有铁离子,物质F能被氯气氧化生成铁离子,则F中含有亚铁离子,紫红色金属D是Cu,盐酸和C反应生成亚铁盐,则C是Fe、F是FeCl2,再结合物质的性质解答.
解答 解:金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,A的焰色反应为黄色,则A是Na,钠和水反应生成氢氧化钠和氢气,则甲是H2、I是NaOH,氢氧化钠和金属单质B反应生成氢气,则B是Al,黄绿色气体乙是Cl2,丙为HCl,E是盐酸,I和G反应生成红褐色沉淀H,则H是Fe(OH)3、G中含有铁离子,物质F能被氯气氧化生成铁离子,则F中含有亚铁离子,紫红色金属D是Cu,盐酸和C反应生成亚铁盐,则C是Fe、F是FeCl2,
(1)由以上分析可知,B为Al,F为FeCl2,H为Fe(OH)3,
故答案为:Al,FeCl2,Fe(OH)3;
(2)①钠和水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,⑥为Cu和铁离子的氧化还原反应生成亚铁离子和铜离子,离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Fe3++Cu=2Fe2++Cu2+;
(3)Cl2与SO2气体都具有漂白性,将等体积的Cl2和SO2通入到水中,会发生反应Cl2+SO2+2H2O=2HCl+H2SO4,所以得到的溶液不具有漂白性,
故答案为:否;Cl2+SO2+2H2O=2HCl+H2SO4.
点评 本题以Na、Al、Fe及其化合物为载体考查了元素化合物知识,根据焰色反应、物质颜色为突破口采用正逆结合的方法进行推断,熟练知识元素化合物知识,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 通直流电后,溶液中溶质分子分别向两极移动,而胶体中分散质粒子向某一极移动 | |
| B. | 向Fe(OH)3胶体中不断滴加稀硫酸,最终胶体聚沉产生红褐色沉淀 | |
| C. | 硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路 | |
| D. | 溶液中溶质粒子的运动有规律,胶体粒子运动无规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
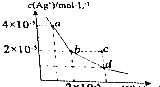 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
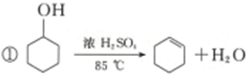
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环乙醇 | 0.96 | 25.93 | 161 | 能溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
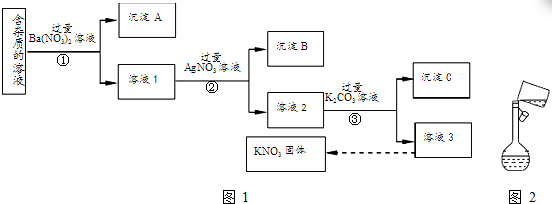
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com