
【题目】用如图所示的装置(夹持与加热仪器省略)进行实验,将A中浓硫酸逐滴加入B中(放有木炭),回答下列问题:

(1)图中C装置在实验中的作用是____________。
(2)木炭与浓硫酸反应的化学方程式为____________。
(3)产生的气体通往D中,下列有关实验现象或结论正确的是____________。
A.若D中放有足量的BaCl2溶液,可以产生两种白色沉淀
B.若D中放有足量的Ca(OH)2溶液,可以产生两种白色沉淀
C.若D中放有少量的KMnO4溶液,一段时间后溶液褪色,可证明木炭与浓硫酸反应,有漂白性气体生成
D.若D中放有少量紫色石蕊溶液,一段时间后,溶液先变红色后褪色
【答案】防倒吸 C+2H2SO4(浓)![]() CO2+2SO2+2H2O B
CO2+2SO2+2H2O B
【解析】
(1)垂直放置的干燥管能够起到防止倒吸作用;
(2)碳与浓硫酸在加热条件下生成二氧化硫、二氧化碳、水;
(3)A.根据强酸遇弱酸盐反应制备弱酸的原理进行分析;
B.二氧化硫、二氧化碳均属于酸性氧化物,能够和碱反应;
C.二氧化硫具有还原性,能够被氧化;
D.二氧化硫属于酸性氧化物,二氧化硫不能漂白酸碱指示剂。
(1)SO2易溶于D中液体,则D中液体上升到C中,因C的球形部分体积较大,当D中液体脱离液面时,由于自身重力作用可回落到D中,所以图中C装置在实验中的作用是防倒吸;
(2)碳与浓硫酸在加热条件下生成二氧化硫、二氧化碳、水,反应方程式是C+2H2SO4(浓)![]() CO2+2SO2+2H2O;
CO2+2SO2+2H2O;
(3)A.二氧化硫、二氧化碳和BaCl2溶液不反应,若D中放有足量的BaCl2溶液,无现象,故A错误;
B.二氧化硫和Ca(OH)2溶液反应生成亚硫酸钙沉淀,二氧化碳和Ca(OH)2溶液反应生成碳酸钙沉淀,故B正确;
C.二氧化硫与KMnO4溶液发生氧化还原反应,一段时间后KMnO4溶液褪色,证明二氧化硫有还原性,故C错误;
D.二氧化硫和水反应生成亚硫酸,亚硫酸能使石蕊溶液变红,但二氧化硫不能使石蕊溶液褪色,故D错误;
选B。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,具有巨大的开发潜力。
Ⅰ.海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
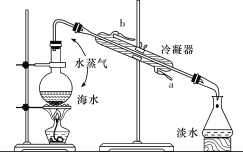
(1)冷却水的出水口是________(填“a”或“b”);
(2)碎瓷片的作用是__________。
Ⅱ.目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是_____________(填“富集溴”或“萃取溴”);
(2)在步骤③中,反应生成HBr的化学方程式___________________________________________;
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间产体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图示的反应。
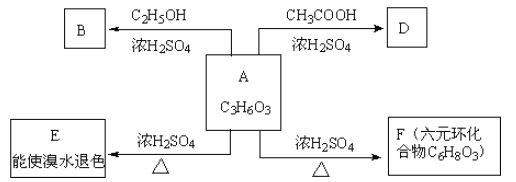
试写出: (1) 化合物A的结构简式________________ 。A→E反应的基本类型_____________。
(2)A自身在不同条件下可以形成不同的酯,其结构简式按相对分子质量由小到大依次是___________、_____________、_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的是
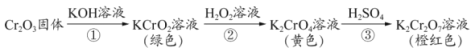
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应②的离子方程式为2CrO2ˉ+3H2O2+2OHˉ=2CrO42ˉ+4H2O
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。已知:A、D同主族,A元素的原子半径在周期表中最小;B元素最高正价与最低负价之和为2;C、E元素原子的最外层电子数均是最内层电子数的3倍。回答下列问题:
(1)E在元素周期表中的位置为_________;B单质的电子式为_________(用元素符号表示)。
(2)元素A、C可形成A2C2型化合物,该化合物中存在的化学键为_________(填字母)。
a.仅有离子键b.仅有共价键c.既有离子键又有共价键
(3)化合物M、N均由A、C、D、E四种元素构成,它们在溶液中相互反应的离子方程式是_________。(4)B的气态氢化物极易溶于水,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.5.6g铁与足量盐酸反应转移的电子数为0.3NA
B.100mL2.0mol/L的氢氧化钠溶液与氢氧化钡溶液中氢氧根离子均为0.2NA
C.标准状况下,22.4L氦气与11.2L氯气所含原子数均为NA
D.16g18O2与16g16O3所含的中子数均是8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成B的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成nmolA,同时生成2nmolC
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com