
| Ź±¼ä/ĪļÖŹµÄĮæ | n£ØA£©£Ømol£© | n£ØB£©£Ømol£© | n£ØC£©£Ømol£© | n£ØD£©£Ømol£© |
| ĘšŹ¼ | 0.9 | 1.4 | 0 | 0.2 |
| µŚ1min | 0.6 | 1.1 | 0.15 | |
| µŚ2min | 0.4 | 0.9 | 0.25 | |
| µŚ3min | 0.3 | 0.8 | 0.8 | |
| µŚ4min | 0.3 | 0.8 | 0.3 | 0.8 |
| µŚ5min | 0.35 | 0.85 | 0.275 | 0.75 |
| ”÷c |
| ”÷t |
| 1.4mol-0.9mol |
| 1L |
| 0.5mol/L |
| 2min |
| 0.6mol |
| 0.9mol |
| m |
| V |


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ŌŚŅ»øöČŻ»ż¹Ģ¶ØĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦mA£Øg£©+nB£Øg£©ØTpC£Øg£©”÷H=£æ£®·“Ó¦ĒéæöČēĻĀĶ¼ĖłŹ¾£ŗ
ŌŚŅ»øöČŻ»ż¹Ģ¶ØĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦mA£Øg£©+nB£Øg£©ØTpC£Øg£©”÷H=£æ£®·“Ó¦ĒéæöČēĻĀĶ¼ĖłŹ¾£ŗ| 10 |
| 9 |
| 10 |
| 9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğŗÓÄĻŹ”Ę½¶„ɽŹŠø߶žĻĀŃ§ĘŚĘŚÄ©æ¼ŹŌĄķæĘ×ŪŗĻ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
(13·Ö)Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) CH3OH(g)+H2O(g)£¬ĻĀĶ¼±ķŹ¾øĆ·“Ó¦½ųŠŠ¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ”£
CH3OH(g)+H2O(g)£¬ĻĀĶ¼±ķŹ¾øĆ·“Ó¦½ųŠŠ¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ”£
£Ø1£©Ķ¼ÖŠĒśĻß (Ģī”°a”±»ņ”°b”±)±ķŹ¾Ź¹ÓĆ“ß»Æ¼ĮŹ±µÄ·“Ó¦½ų³Ģ”£Ź¹ÓĆ“ß»Æ¼Į¶ŌøĆ·“Ó¦µÄÓ°ĻģŹĒ______(ĢīŃ”Ļī×ÖÄø)”£
| A£®Ģįøß·“Ó¦ĖŁĀŹ | B£®ĢįøßCO2µÄ×Ŗ»ÆĀŹ |
| C£®½µµĶ·“Ó¦»ī»ÆÄÜ | D£®øı䷓ӦµÄ¦¤H |
 CH3OH(g)+H2O(g)µÄ»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K=_________”£ÉżøßĪĀ¶Č£¬KÖµ½«_______(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
CH3OH(g)+H2O(g)µÄ»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K=_________”£ÉżøßĪĀ¶Č£¬KÖµ½«_______(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£ CH3OH(g)+H2O(g)µÄ¦¤H="_____" kJ”¤mol£1
CH3OH(g)+H2O(g)µÄ¦¤H="_____" kJ”¤mol£1²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¹ć¶«Ź”ÕŲĒģŹŠø߶žÉĻŃ§ĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ŌŚ³£ĪĀ”¢³£Ń¹”¢¹āÕÕĢõ¼žĻĀ£¬N2ŌŚ“߻ƼĮ±ķĆęÓėĖ®·¢ÉśĻĀĮŠ·“Ó¦£ŗ
2N2 (g)+6H2O (l)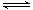 4NH3 (g)+3O2 (g)
¦¤H£½ a kJ”¤mol£1
4NH3 (g)+3O2 (g)
¦¤H£½ a kJ”¤mol£1
ÉĻŹö·“Ó¦NH3Éś³ÉĮæÓėĪĀ¶ČµÄ¹ŲĻµ£¬³£Ń¹ĻĀ“ļµ½Ę½ŗāŹ±²āµĆ²æ·ÖŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
|
ĪĀ¶Č T/K |
303 |
313 |
323 |
|
NH3Éś³ÉĮæ/(10£6 mol) |
4.8 |
5.9 |
6.0 |
£Ø1£©“ĖŗĻ³É·“Ó¦µÄa 0 (Ģī”°£¾”±”¢”°£¼”±»ņ”°£½”±)”£
£Ø2£©ÓĆĖ®Ļ”ŹĶ0.1 mol”¤L£1°±Ė®£ØÉčĻ”ŹĶŹ±ČÜŅŗĪĀ¶Č²»±ä£©£¬ŌņČÜŅŗÖŠĖę×ÅĖ®ĮæµÄŌö¼Ó¶ų¼õŠ”µÄŹĒĻĀĮŠµÄ £ØĢīŠņŗÅ£©£ŗ
A£®c(NH3”¤H2O)
B£®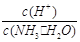 C£®c(H+)”¤c(OH£)
D£®
C£®c(H+)”¤c(OH£)
D£®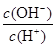
£Ø3£©¹¤ŅµÓĆ°±ÖĘČ”ĻõĖįµÄŃõ»Æ·“Ó¦ĪŖ£ŗ4NH3(g)+5O2(g)
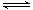 4NO(g)+6H2O(g)
¦¤H£¼0£¬ČōĘšŹ¼µÄĪļÖŹµÄĮæĻąĶ¬£¬ŌņĻĀĮŠ¹ŲĻµĶ¼ÕżČ·µÄŹĒ________(ĢīŠņŗÅ)£ŗ
4NO(g)+6H2O(g)
¦¤H£¼0£¬ČōĘšŹ¼µÄĪļÖŹµÄĮæĻąĶ¬£¬ŌņĻĀĮŠ¹ŲĻµĶ¼ÕżČ·µÄŹĒ________(ĢīŠņŗÅ)£ŗ
A B C D
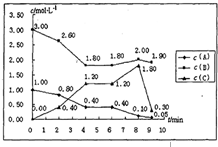
£Ø4£©ŌŚ1LČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬²æ·ÖĪļÖŹµÄĪļÖŹµÄĮæÅضČČēĻĀ±ķ£ŗ
|
Ź±¼ä/ÅØ¶Č |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
|
ĘšŹ¼ |
0.8000 |
1.600 |
0.000 |
|
µŚ4 min |
0.3000 |
0.9750 |
0.5000 |
|
µŚ6 min |
0.3000 |
0.9750 |
0.5000 |
|
µŚ8 min |
0.7000 |
1.475 |
0.1000 |
·“Ó¦ŌŚµŚ6 minµ½8minŹ±øıäĮĖĢõ¼ž£¬øıäµÄĢõ¼žæÉÄÜŹĒ___________________£»ŌŚøĆĢõ¼žĻĀ£¬Ę½ŗāĻņ_______ŅʶÆ(Ģī”°×ó”±»ņ”°ÓŅ”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģŗÓÄĻŹ”Ę½¶„ɽŹŠø߶žĻĀŃ§ĘŚĘŚÄ©æ¼ŹŌĄķæĘ×ŪŗĻ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(13·Ö)Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) CH3OH(g)+H2O(g)£¬ĻĀĶ¼±ķŹ¾øĆ·“Ó¦½ųŠŠ¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ”£
CH3OH(g)+H2O(g)£¬ĻĀĶ¼±ķŹ¾øĆ·“Ó¦½ųŠŠ¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ”£
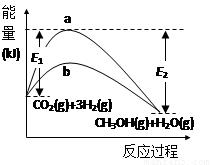
£Ø1£©Ķ¼ÖŠĒśĻß (Ģī”°a”±»ņ”°b”±)±ķŹ¾Ź¹ÓĆ“ß»Æ¼ĮŹ±µÄ·“Ó¦½ų³Ģ”£Ź¹ÓĆ“ß»Æ¼Į¶ŌøĆ·“Ó¦µÄÓ°ĻģŹĒ______(ĢīŃ”Ļī×ÖÄø)”£
A£®Ģįøß·“Ó¦ĖŁĀŹ B£®ĢįøßCO2µÄ×Ŗ»ÆĀŹ
C£®½µµĶ·“Ó¦»ī»ÆÄÜ D£®øı䷓ӦµÄ¦¤H
£Ø2£©CO2(g)+3H2(g) CH3OH(g)+H2O(g)µÄ»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K=_________”£ÉżøßĪĀ¶Č£¬KÖµ½«_______(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
CH3OH(g)+H2O(g)µÄ»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K=_________”£ÉżøßĪĀ¶Č£¬KÖµ½«_______(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
£Ø3£©ÓĆŗ¬E1”¢E2µÄ±ķ“ļŹ½±ķŹ¾CO2(g)+3H2(g) CH3OH(g)+H2O(g)µÄ¦¤H=_____ kJ”¤mol£1
CH3OH(g)+H2O(g)µÄ¦¤H=_____ kJ”¤mol£1
£Ø4£©Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė2molCO2”¢6molH2£¬¾10min·“Ó¦“ļµ½Ę½ŗāדĢ¬W£¬Éś³É1molCH3OH”£CO2µÄ×Ŗ»ÆĀŹĪŖ________”£“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ÓĆH2µÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(H2)=____________”£øĆĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ1LµÄČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬“ÓÄę·“Ó¦æŖŹ¼½ØĮ¢»ÆŃ§Ę½ŗā£¬ĒŅø÷×é·ÖµÄĘ½ŗāÅضČÓėĘ½ŗāדĢ¬WĶźČ«ĻąĶ¬£¬ŌņĘšŹ¼Ź±³äČėČŻĘ÷µÄn(CH3OH)=________£¬n(H2O)=________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com