
| A. | 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 | |
| B. | 在有AgI沉淀的上层清液中滴加一定浓度的NaCl溶液,不可能产生白色沉淀 | |
| C. | pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+>c(Cl-)>c(OH-)>c(H+) | |
| D. | 室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
分析 A.升高温度,促进铵根离子水解,酸性增强,水的电离吸热;
B.AgI沉淀的上层清液中滴加一定浓度的NaCl溶液,Qc(AgCl)>Ksp(AgCl)时生成AgCl沉淀;
C.pH=3的盐酸与pH=11的氨水等体积混合后,氨水浓度大于0.001mol/L,则氨水剩余,为氯化铵、一水合氨的混合溶液;
D.稀释0.1mol•L-1CH3COOH溶液,促进电离,但离子浓度减小.
解答 解:A.升高温度,促进铵根离子水解,酸性增强,水的电离吸热,则水的离子积常数增大,但pH减小,故A错误;
B.AgI沉淀的上层清液中滴加一定浓度的NaCl溶液,Qc(AgCl)>Ksp(AgCl)时生成AgCl沉淀,则可能产生白色沉淀,故B错误;
C.pH=3的盐酸与pH=11的氨水等体积混合后,氨水浓度大于0.001mol/L,则氨水剩余,为氯化铵、一水合氨的混合溶液,溶液显碱性,一水合氨电离大于铵根离子水解,则离子浓度为c(NH4+>c(Cl-)>c(OH-)>c(H+),故C正确;
D.稀释0.1mol•L-1CH3COOH溶液,促进电离,但离子浓度减小,则溶液的导电能力减弱,故D错误;
故选C.
点评 本题考查酸碱混合、弱电解质的电离及盐类水解,为高频考点,把握温度对盐类水解的影响、沉淀生成、酸碱混合后溶液中的溶质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 60、12 | B. | 12、30 | C. | 30、12 | D. | 10、30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光纤通信使用的光缆主要成分是晶体Si | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 氯水、酒精能杀菌消毒,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、草帽、增白食品等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
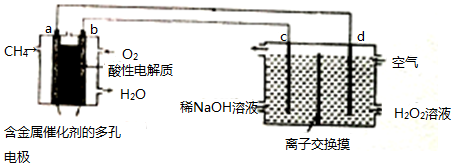
| A. | 电解池装置应选择阳离子交换膜 | |
| B. | d 极的电极反应式为:O2+2e-+2H+=H2O2 | |
| C. | 当有16g甲烷参与原电池反应时,可制备4 mol H2O2 | |
| D. | 工作时,a、c电极附近的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用一次性木筷,减少疾病传染 | |
| B. | 将地沟油回收重新加工为食用油,提高资源的利用率 | |
| C. | 推广使用电动汽车、天然气汽车等公共交通工具,保护环境 | |
| D. | 推广使用煤的气化、液化技术可减少二氧化碳等温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| ① | 2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g)△H1 | K1 |
| ② | 4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 | K2 |
| ③ | 2NO(g)+Cl2(g)?2NOCl(g)△H3 | K3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率VB(正)=VC(逆) | B. | B、C物质的量之比保持不变 | ||
| C. | B的体积分数不变 | D. | 混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
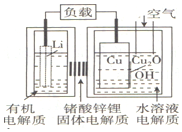 近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过同体电解质向Cu极移 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 通空气时,整个反应过程中,铜相当于是催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )| A. | 尿素由碳、氮、氧、氢四种元素组成的有机化合物 | |
| B. | 尿素在阳极被氧化,当生成1 mol N2时,转移电子为6 mol | |
| C. | a、b两处生成的气体体积比为1:3 | |
| D. | 假设电解过程中溶液体积不变,电解后排出液的pH比通入前大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com