
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于是试管中, 取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 |
|
| 步骤4: |
0.25L×
| ||
| wg |
0.25L×
| ||
| wg |
查看答案和解析>>
科目:高中化学 来源: 题型:
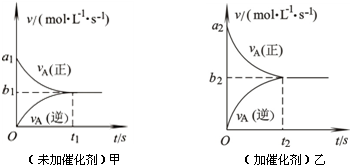
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)==3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
⑴可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A、体系压强不再变化 B、v正(A)=2v逆(B)
C、体系的密度不再变化 D、混合气体的平均相对分子质量不再变化
⑵如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:
C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是
A、4molA+2molB B、6molC+1molD
C、1molA+0.5molB+1.5molC+0.5molD D、2molA+1molB+3molC+1molD
E、2molA+1molB+3molC+2molD
⑶若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是 (用含W的代数式表示)
⑷此反应的v—t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则
其v—t图象如乙图,请用“=、<、>”填空:①a1 a2;②b1 b2;③两图中
阴影部分面积:甲 乙。

查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省高三上学期期中考试理科综合试题(化学部分) 题型:实验题
(16分)某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
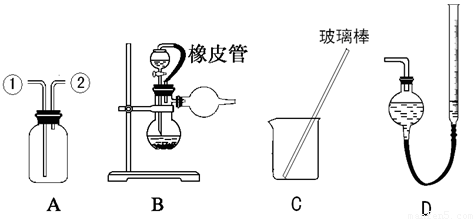

【实验一】收集NO气体。
 (1)用装置A收集NO气体,正确的操作是 (填序号)。
(1)用装置A收集NO气体,正确的操作是 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
(2)请参照装置A,画出净化Cl2装置图,标明所盛的药品,标注气体的流动方向。
【实验三】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑ 据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用NaOH溶液作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
(3)选用 和 (填仪器标号)两个装置进行实验。
(4) 测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=
。
测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=
。
(5)计算镀层厚度,还需要检索的一个物理量是 。
(6) 若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将
(填“偏大”、“偏小”或“无影响”)。
若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将
(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g  ;
;
(7)w(Zn)= 。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高三上学期第二次月考化学试题 题型:实验题
(11分) 某研究性小组借助A-D的仪器装置完成有关实验
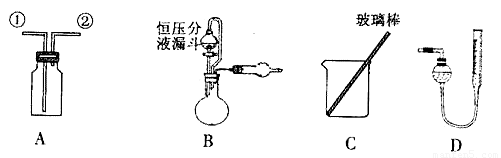
【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),w(Zn) = 。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(5)w(Zn) 。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com