
| A. | 5:6 | B. | 6:5 | C. | 3:5 | D. | 5:3 |
分析 32gCH30H转移6mol电子,即1mol还原剂参加反应转移6mol电子,根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少.
解答 解:消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故选:A.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度中等.


科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
下列关于2C4H10(g)+13O2(g)==8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述中错误的是( )
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5 800 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列有关溶液的说法不正确的是
A.Na2CO3、NaHCO3两种盐溶液中,离子种类相同
B.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
C.某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a >7,则该溶液的pH为a或14-a
D.相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比大于2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- | |
| B. | 向某溶液中加稀HCl,无明显现象,再加入BaCl2溶液产生白色沉淀,证明有SO42- | |
| C. | 除去稀HCl中的少量H2SO4,可加入适量的Ba(NO3)2后再过滤 | |
| D. | 除去NaCl溶液中少量的Na2CO3,可加入适量的H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
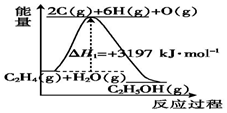 乙醇用途广泛,常用作溶剂、饮料、燃料等.
乙醇用途广泛,常用作溶剂、饮料、燃料等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0 | |
| B. | 滴加Cu(NO3)2溶液可以加快Zn与稀H2SO4反应制备氢气的速率 | |
| C. | 氯水中加入少量CaCO3粉末,可以提高漂白能力 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
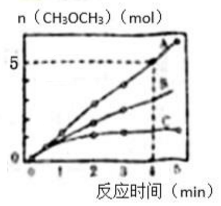 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).| 序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
| I | 2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
| III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com