


| 112 |
| 160 |
| 152 |
| 56 |
| 1.7024g |
| 0.3g×10 |


科目:高中化学 来源:不详 题型:实验题

| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
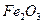 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)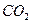 气体
气体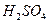 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.剩余固体一定是铁 |
| B.剩余固体一定是铜 |
| C.反应后溶液中一定有Fe2+ |
| D.反应后溶液中滴入KSCN溶液可能变成红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀盐酸洗去残留在试管壁上的铜 |
| B.用碱石灰吸收氨气中的水蒸气 |
| C.用稀盐酸清洗做焰色反应的铂丝 |
| D.用CCl4萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com